Hòa tan hoàn toàn 11,2 gam CaO vào nước ta thu được dung dịch A. Nếu hòa tan hoàn toàn 28,1 gam hỗn hợp MgCO3 và BaCO3 (trong đó chứa a% MgCO3 về khối lượng) bằng dung dịch HCl và cho tất cả khí thoát ra hấp thụ hết vào dung dịch A thì thu được kết tủa D. Hỏi a có giá trị bao nhiêu để kết tủa D lớn nhất?
A. 18,73
B. 43,93
C. 56,19
D. 29,89


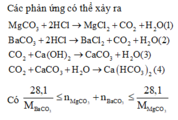
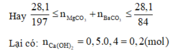
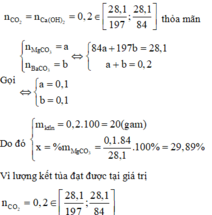
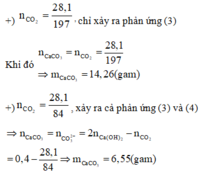
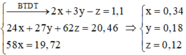
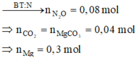
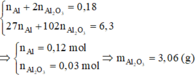
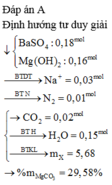

Đáp án D
CaO + H2O→ Ca(OH)2
Ta có : n C a ( O H ) 2 = nCaO = 0,2 mol
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑ (4)
BaCO3 + 2HCl → BaCl2 + H2O + CO2↑ (5)
CO2 + Ca(OH)2 → CaCO3↓ + H2O (6)
CO2 + CaCO3 + H2O → Ca(HCO3)2 (7)
m M g C O 3 = 28,1 . a% = 0,281a
m B a C O 3 = 28,1 – 0,281a
Theo PTHH (4): n C O 2 ( 4 ) = n M g C O 3 = 0 , 281 a 84
Theo PTHH (5): n C O 2 = n B a C O 3 = 28 , 1 - 0 , 281 a 197
⇒ Tổng số mol CO2 = 0 , 281 a 84 + 28 , 1 - 0 , 281 a 197
Khối lượng kết tủa D lớn nhất khi CO2 phản ứng vừa đủ với Ca(OH)2 ở (6). Có nghĩa là:
Số mol CO2 = 0 , 281 a 84 + 28 , 1 - 0 , 281 a 197 = 0,2
Giải ra ta được a = 29,89%.