Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_{H_2}=0,2\left(mol\right)\)
Bảo toàn nguyên tố H : \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\)
=> \(n_{Cl^-}=0,4\left(mol\right)\)
=> \(m_{muối}=m_{KL}+m_{Cl^-}=20+0,4.35,5=34,2\left(g\right)\)

Câu 1
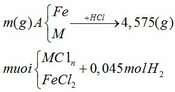
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
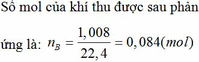
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
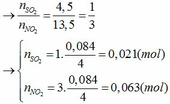
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
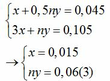
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ n_{Mg}=a(mol);n_{Fe}=b(mol)\\ \Rightarrow 24a+27b=4,46(1)\\ Fe+H_2SO_4\to FeSO_4+H_2\\ Mg+H_2SO_4\to MgSO_4+H_2\\ \Rightarrow a+b=0,1(2)\\ (1)(2)\Rightarrow a=\dfrac{-44}{75}(mol);b=\dfrac{103}{150}(mol)\)
Đề sai, bạn xem lại đề

Câu 48:
\(n_{Al}=x(mol);n_{Fe}=y(mol)\\ \Rightarrow 27x+56y=11(1)\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow 1,5x+y=\dfrac{8,96}{22,4}=0,4(2)\\ (1)(2)\Rightarrow x=0,2(mol);y=0,1(mol)\\ \Rightarrow n_{AlCl_3}=0,2(mol);n_{FeCl_2}=0,1(mol)\\ \Rightarrow m_{muối}=0,2.133,5+0,1.127=39,4(g)(B)\)
Câu 49:
\(n_{Al}=x(mol);n_{Fe}=y(mol)\\ \Rightarrow 27x+56y=4,15(1)\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow 1,5x+y=\dfrac{2,8}{22,4}=0,125(2)\\ (1)(2)\Rightarrow x=y=0,05(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,05.56}{4,15}.100\%=67,5\%\\ \Rightarrow \%_{Al}=100\%-67,5\%=32,5\%\\ \Rightarrow B\)
Câu 50:
\(Fe+H_2SO_4\to FeSO_4+H_2\\ Mg+H_2SO_4\to MgSO_4+H_2\\ FeSO_4+2NaOH\to Fe(OH)_2\downarrow+Na_2SO_4\\ MgSO_4+2NaOH\to Mg(OH)_2\downarrow+Na_2SO_4\\ 4Fe(OH)_2+O_2\xrightarrow{t^o}2Fe_2O_3+4H_2O\\ Mg(OH)_2\xrightarrow{t^o}MgO+H_2O\\ \Rightarrow n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=\dfrac{11,2}{56}=0,1(mol)\\ n_{MgO}=n_{Mg}=\dfrac{2,4}{24}=0,1(mol)\\ \Rightarrow \Sigma m_{\text{chất rắn}}=0,1.160+0,1.40=20(g)\)
Chọn B

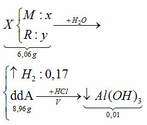
TH1: kết tủa Al(OH)3 chưa bị hòa tan
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,01 ←0,01
→ nHCl = 0,02
→ V = 0,02 (lít) = 20 (ml)
TH2: kết tủa Al(OH)3 bị hòa tan một phần
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,05 → 0,05 0,05
Al(OH)3 + 3HCl → AlCl3 + 3H2O
0,04` → 0,12
→ nHCl = 0,18 → V = 0,18 (l) = 180 (ml)
Vậy có 2 giá trị của V thỏa mãn là: 20 ml và 180 ml



vc anh nam