Câu 1. Nguyên tử khối trung bình của đồng bằng 63,546. Đồng tồn tại trong tự nhiên dưới hai dạng đồng vị 2963Cu và 2965Cu . Tính tỉ lệ % số nguyên tử đồng 2963Cu tồn tại trong tự nhiên.
Câu 2: Trong tự nhiên Brom tồn tại chủ yếu dưới hai đồng vị 7935Br và 3581Br . Biết nguyên tử khối trung bình của Brom là 79,9862. Tính phần trăm của đồng vị 7935Br.
Loại 2: Cho nguyên tử khối trung bình và số khối của từng đồng vị thứ nhất để tính số khối đồng vị thứ hai.
Câu 1: Trong tự nhiên Ag tồn tại chủ yếu dưới dạng hai đồng vị trong đó 107Ag chiếm 56%. Biết nguyên tử khối trung bình của Ag là 107,88. Tính số khối của đồng vị còn lại.
Câu 2: Khối lượng nguyên tử trung bình của antimon là 121,76. Antimon có 2 đồng vị, biết đồng vị 12151Sb chiếm 62%. Tìm số khối của đồng vị thứ 2.
Câu 3: Nguyên tử khối trung bình của nguyên tố R là 79,91; R có 2 đồng vị. Biết 79Z R chiếm
54,5%. Tính nguyên tử khối của đồng vị thứ 2?
Loại 3: Cho số khối và % các đồng vị để tính số khối trung bình.
Câu 1: Cho biết các đồng vị thuộc nguyên tố Argon: 4018Ar (99,63%); 3618 Ar (0,31%); 3818Ar (0,06%). Tính nguyên tử khối trung bình của Ar.
Câu 2: Tính khối lượng nguyên tử trung bình của niken, biết rằng trong tự nhiên, các đồng vị của niken tồn tại như sau:
58
Đồng vị 28Ni 6028Ni 2861Ni 6228Ni 6428Ni
Thành phần % 68,27 26,10 1,13 3,59 0,91 Tính nguyên tử khối trung bình của Ni.
Câu 3: Trong tự nhiên, gali có hai đồng vị là 69 Ga (60,1%) và 71Ga (39,9%). Tính nguyên tử khối trung bình của Ga.
Câu 4: Bo có 2 đồng vị: 105 B (18,89%) và 115 B (81,11%). Nguyên tử khối trung bình của nguyên tố Bo là bao nhiêu?
Câu 5: (vận dụng) Một nguyên tố X gồm hai đồng vị là X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng % các đồng vị trong X bằng nhau và các loại hạt trong X1 cũng bằng nhau. Tính nguyên tử khối trung bình của X?
Loại 4: Cho số khối của các đồng vị để từ đó thành lập công thức của các hợp chất
Câu 1: Oxi có 3 đồng vị 168 O; 178 O; 188 O và hiđro có hai đồng vị bền là 11H và 21 H. Hỏi có thể có bao nhiêu loại phân tử nước có thành phần đồng vị khác nhau?
Câu 2: Oxi có ba đồng vị là: 168 O; 178 O; 188 O và cacbon có hai đồng vị là: 126 C và 136 C. Hỏi có thể có bao nhiêu loại phân tử khí cacbonic có thành phần đồng vị khác nhau?
Câu 3: Cho hai đồng vị hiđro và hai đồng vị của clo với tỉ lệ phần trăm số nguyên tử chiếm trong tự nhiên như sau: 11H; 21 H và clo: 1735 Cl; 3717 Cl. Có thể có bao nhiêu loại phân tử HCl khác nhau tạo nên từ hai loại đồng vị của hai nguyên tố đó.

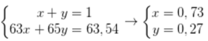
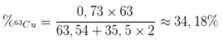

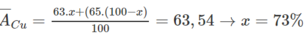
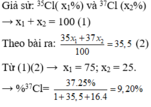
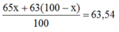

Ta có: \(63,54=\frac{63.x+65.\left(100-x\right)}{100}\)
\(\Rightarrow\%^{63}_{29}Cu=x=73\%;\%^{65}_{29}Cu=100-73=27\%\)
Đặt nCuCl2=1 mol
=> nCu=1 mol
=> \(n_{^{63}_{29}Cu}=1.73\%=0,73\left(mol\right)\)
%m63Cu/mCuCl2=\(\frac{63.0,73}{1.\left(63,54+35.2\right)}.100=34,44\%\)
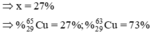
Có:63.x%+65.(100-x)%=63,54.
=>x=27(%)
Xét 1 mol CuCl2.
\(n_{^{63}_{29}Cu}=1.27\%=0,27\left(mol\right)\)\(\Rightarrow m_{^{63}_{29}Cu}=17,01\left(g\right)\)
\(\Rightarrow\%_{^{63}_{29}Cu}=\frac{17,01}{64+35,5.2}.100=12,6\left(\%\right)\)
#Walker