CÂU 6: Cho 7,1 gam P2O5 tác dụng hết với 100 gam dung dịch KOH x% thu được dung
dịch K3PO4. Dung dịch thu được có khối lượng (gam), nồng độ phần trăm và giá trị của x lần
lượt là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
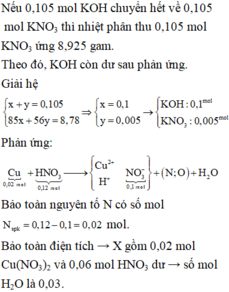
Nếu 0,105 mol KOH chuyển hết về 0,105 mol KNO3 thì nhiệt phân thu 0,105 mol KNO3 ứng 8,925 gam.
Theo đó, KOH còn dư sau phản ứng. Giải hệ:
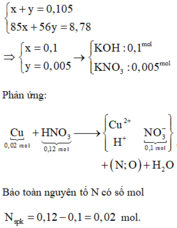
Bảo toàn điện tích → X gồm 0,02 mol Cu(NO3)2 và 0,06 mol HNO3 dư → số mol H2O là 0,03.
Ghép cụm hoặc bảo toàn nguyên tố O có ngay số mol Ospk = 0,03 mol.


Đáp án A
![]()
![]()
Giả sử KOH hết => rắn chứa
![]()
=> trái gt =>KOHdư=>rắn gồm KOH dư và K N O 2 với số mol x và y.
Ta có:
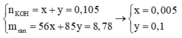
Bảo toàn nguyên tố Nitơ: n N / k h í = 0 , 02 m o l
Bảo toàn điện tích trong X: 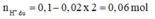
Bảo toàn nguyên tố Hiddro: ![]()
Bảo toàn nguyên tố Oxi: ![]()
Bảo toàn khối lượng: m d d s a u p . ư = 13 , 12 ( g )
![]()
= 28,66%

Đáp án A
nCu = 0,02 mol; nHNO3 = 0,12 mol; nKOH = 0,105 mol.
● GIẢ SỬ KOH hết ⇒ rắn chứa 0,105 mol KNO2 ⇒ mrắn ≥ mKNO2 = 8,925(g).
⇒ trái gt ⇒ KOH dư ⇒ rắn gồm KOH dư và KNO2 vối số mol x và y.
► Ta có:
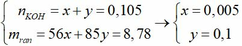
||⇒ nNO3– = nKNO2 = 0,1 mol. Bảo toàn nguyên tố Nitơ: nN/khí = 0,02 mol.
Bảo toàn điện tích trong X: nH+ dư = 0,1 – 0,02 × 2 = 0,06 mol.
Bảo toàn nguyên tố Hidro: nH2O = (0,12 – 0,06) ÷ 2 = 0,03 mol.
Bảo toàn nguyên tố Oxi: nO/khí = 0,12 × 3 – 0,1 × 3 – 0,03 = 0,03 mol.
● Bảo toàn khối lượng: mdung dịch sau phản ứng = 13,12(g).
||⇒ C%Cu(NO3)2 = 0,02 × 188 ÷ 13,12 × 100% = 28,66%

Đáp án A
nCu = 0,02 mol; nHNO3 = 0,12 mol; nKOH = 0,105 mol.
● GIẢ SỬ KOH hết ⇒ rắn chứa 0,105 mol KNO2 ⇒ mrắn ≥ mKNO2 = 8,925(g).
⇒ trái gt ⇒ KOH dư ⇒ rắn gồm KOH dư và KNO2 vối số mol x và y.
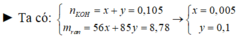
||⇒ nNO3– = nKNO2 = 0,1 mol. Bảo toàn nguyên tố Nitơ: nN/khí = 0,02 mol.
Bảo toàn điện tích trong X: nH+ dư = 0,1 – 0,02 × 2 = 0,06 mol.
Bảo toàn nguyên tố Hidro: nH2O = (0,12 – 0,06) ÷ 2 = 0,03 mol.
Bảo toàn nguyên tố Oxi: nO/khí = 0,12 × 3 – 0,1 × 3 – 0,03 = 0,03 mol.
● Bảo toàn khối lượng: mdung dịch sau phản ứng = 13,12(g).
||⇒ C%Cu(NO3)2 = 0,02 × 188 ÷ 13,12 × 100% = 28,66%

\(n_{P_2O_5}=\dfrac{7,1}{142}=0,05\left(mol\right)\)
\(P_2O_5+3H_2O\xrightarrow[]{}2H_3PO_4\)
0,05 → 0,15 → 0,1
\(\Rightarrow m_{H_3PO_4}=0,1\cdot98=9,8\left(g\right)\)
\(\Rightarrow m_{H_2O}\left(\text{pư}\right)=0,15\cdot18=2,7\left(g\right)\)
\(\Rightarrow m_{H_2O}\left(\text{dm}\right)=100-2,7=97,3\left(g\right)\)
\(\Rightarrow m_{H_3PO_4}\left(\text{dd}\right)=m_{H_3PO_4}+m_{H_2O}\left(\text{dm}\right)=9,8+97,3=107,1\left(g\right)\)
\(\Rightarrow C\%=\dfrac{m_{H_3PO_4}}{m_{H_3PO_4}\left(\text{dd}\right)}\cdot100\%=\dfrac{9,8}{107,1}\cdot100\%\approx9,15\%\)

Chọn B.
Gọi a và b lần lượt là số mol của Fe và Cu. Xét hỗn hợp chứa 20 gam Fe2O3 và CuO ta có :
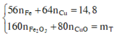
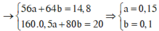
Dung dịch T gồm K+, Na+, OH- và NO3-. Khi nung chất rắn khan T thì :
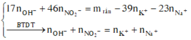

Dung dịch X gồm Fe2+, Fe3+, Cu2+(0,2 mol) và NO3- (với ). Xét X có:
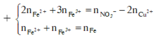
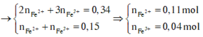
![]()
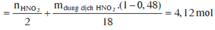
![]()
![]()

Đáp án B
n H N O 3 = 0,96 mol và n N a O H = 0,4 mol, n K O H = 0,2
đặt n F e = x mol và n C u = y mol
Bảo toàn nguyên tố có n F e 2 O 3 = ½ . n F e = ½ .x
n C u O = n C u = y
Ta có hệ phương trình sau 56x + 64 y = 14,8 gam và 80x + 80y = 20
→ x = 0,15 mol và y = 0,1 mol
Nếu dung dịch Z chỉ chứa 2 muối N a N O 3 và K N O 3 thì khi đun nóng thu được K N O 2 và N a N O 2
Bảo toàn nguyên tố có n N a N O 2 = n N a O H = 0,4 và n K O H = 0,2 = n K N O 2
→ mrắn = 0,4.69 +0,2. 85 = 44,6 gam > 42,86 nên Z còn chứa cả NaOH và KOH
Z chứa : N a + : 0,4 mol; K + : 0,2 mol; OH- : a mol và N O 3 - : b mol
Bảo toàn điện tích có 0,4 + 0,2 = a + b (*)
Đun nóng Z có 0,4 mol Na ; K + : 0 , 2 m o l ; O H - : a m o l v à N O 2 - : b m o l
→ 17a + 46b + 0,2.39 + 0,4.23 = 42,86 (**)
Từ (*) và (**) → a = 0,06 và b = 0,54
→ dd X chứa F e 2 + : c m o l ; F e 3 + : d m o l v à C u 2 + : 0 , 1 m o l ; N O 3 - : 0 , 54 m o l (cùng bằng lượng NO3- trong Z)
Bảo toàn điện tích có 2c + 3d + 0,1.2 = 0,54 (***)
Bảo toàn Fe có c + d =0,15 (****)
Từ (***) và (****) → c = 0,11 và d =0,04 mol
Bảo toàn nguyên tố có n N (sp khử) = n H N O 3 – n N O 3 (Y) = 0,96 – 0,54 =0,42 mol
Quy đổi khí sản phẩm khử là N : 0,42 mol và O : e mol
Bảo toàn e có 2 n F e ( 2 + ) + 3 n F e ( 3 + ) + 2 n C u ( 2 + ) - 2 n O = 5 n N
→ 5.0,42 = 2.0,11 +3.0,04 + 0,1.2 +2e
→ e = 0,78 mol
Bảo toàn khối lượng mdd X = m K L + m H N O 3 – m N – m O
= 14,8 + 126 – 0,42.14 – 0,78.16 =122,44 g
Nồng độ % của F e N O 3 3 là := 7,9%

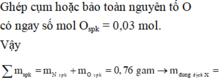


Câu 6:
Ta có: \(n_{P_2O_5}=\dfrac{7,1}{142}=0,05\left(mol\right)\)
PT: \(P_2O_5+6KOH\rightarrow2K_3PO_4+3H_2O\)
____0,05____0,3_______0,1 (mol)
Ta có: m dd sau pư = 7,1 + 100 = 107,1 (g)
\(C\%_{K_3PO_4}=\dfrac{0,1.212}{107,1}.100\%\approx19,8\%\)
\(m_{KOH}=0,3.56=16,8\left(g\right)\)
\(\Rightarrow x=\dfrac{16,8}{100}.100\%=16,8\%\)
Bạn tham khảo nhé!