Cho 8g hỗn hợp Mg và Fe tác dụng vừa đủ với V(l) khí O2 (đktc).Thu được 12g hỗn hợp các loại ô-xit .Tìm V và % mỗi loại khí??????
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1:
\(n_{H_2}=\dfrac{2.91362}{22.4}=0.13mol\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
a a a a
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
2b 3b b 3b
Ta có: \(\left\{{}\begin{matrix}24a+54b=2.58\\a+3b=0.13\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0.04\\b=0.03\end{matrix}\right.\)
\(m_{Mg}=0.04\times24=0.96g\)
\(m_{Al}=0.03\times2\times27=1.62g\)
\(V_{H_2SO_4}=\dfrac{0.04+3\times0.03}{0.5}=0.26l\)
Câu 2:
\(n_{H_2}=\dfrac{3.136}{22.4}=0.14mol\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
a a a a
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b b b b
Ta có: \(\left\{{}\begin{matrix}24a+56b=4.96\\a+b=0.14\end{matrix}\right.\)\(\Leftrightarrow\left\{{}\begin{matrix}a=0.09\\b=0.05\end{matrix}\right.\)
\(m_{Mg}=0.09\times24=2.16g\)
\(m_{Fe}=0.05\times56=2.8g\)
\(C\%_{H_2SO_4}=\dfrac{0.14\times98\times100}{200}=6.86\%\)
Câu 3:
\(n_{H_2}=\dfrac{1.568}{22.4}=0.07mol\)
\(Ba+H_2SO_4\rightarrow BaSO_4+H_2\)
a a a a
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
b b b b
Ta có: \(\left\{{}\begin{matrix}137a+24b=3.94\\a+b=0.07\end{matrix}\right.\)\(\Leftrightarrow\left\{{}\begin{matrix}a=0.02\\b=0.05\end{matrix}\right.\)
\(m_{Ba}=0.02\times137=2.74g\)
\(m_{Mg}=0.05\times24=1.2g\)
\(CM_{H_2SO_4}=\dfrac{0.07}{0.1}=0.7M\)

nH2 = 4,48 : 22,4 = 0,2 mol
gọi x,y lần lượt là số mol của Fe và Mg
PTHH : Fe + 2HCl → FeCl2 + H2
x mol 2x mol x mol
Mg + 2HCl → MgCl2 + H2
y mol 2y mol y mol
Ta có hệt phương trình:
\(\begin{cases}56x+24y=8\\x+y=0,2\end{cases}\)
Giải hệ phương trình ta có : x= 0,1 ; y = 0,1
Thể tích HCl là : VHCl = ( 2x + 2y ) . 22,4
= ( 2.0,1 + 2.0,1 ) . 22,4 = 8,96 lit
Khối lượng Mg là : mMg = 0,1 . 24 = 2,4 g
Khối lượng Fe là : mFe = 0,1 .56 = 5,6 g
@Vy Kiyllie bài này hình như thầy bảo kh đk giải hệ pt thỳ f

Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 11,1 (1)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a----------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b------------------------>b
=> 1,5a + b = 0,3 (2)
(1)(2) => a = 0,1; b = 0,15
=> \(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,1.27}{11,1}.100\%=24,32\%\\\%m_{Fe}=\dfrac{0,15.56}{11,1}.100\%=75,68\end{matrix}\right.\)

Gọi nFe = a (mol); nMg = b (mol)
56a + 24b = 8 (1)
nH2 = 4,48/22,4 = 0,2 (mol)
PTHH:
Fe + 2HCl -> FeCl2 + H2
a ---> a ---> a ---> a
Mg + 2HCl -> MgCl2 + H2
b ---> b ---> b ---> b
a + b = 0,2 (2)
(1)(2) => a = b = 0,1 (mol)
mFe = 0,1 . 56 = 5,6 (g)
%mFe = 5,6/8 = 70%
%mMg = 100% - 70% = 30%
nHCl = 0,1 . 2 + 0,1 . 2 = 0,4 (mol)
CMddHCl = 0,4/0,1 = 4M

PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a_______a_______a_____a (mol)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
2b______3b__________b_____3b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}56a+27\cdot2b=11\\a+3b=0,2\cdot2=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1\cdot56}{11}\cdot100\%\approx50,91\%\\\%m_{Al}=49,09\%\end{matrix}\right.\)
Theo các PTHH: \(\left\{{}\begin{matrix}n_{H_2}=0,4\left(mol\right)\\n_{FeSO_4}=0,1\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,4\cdot22,4=8,96\left(l\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\\C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\end{matrix}\right.\)
a) nH2SO4=0,4(mol)
Đặt: nFe=x(mol); nAl=y(mol) (x,y>0)
PTHH: Fe + H2SO4 -> FeSO4 + H2
x________x______x______x(mol)
2Al + 3 H2SO4 -> Al2(SO4)3 + 3 H2
y____1,5y_______0,5y_______1,5y(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}56x+27y=11\\x+1,5y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=> mFe=0,1.56=5,6(g)
=>%mFe=(5,6/11).100=50,909%
=>%mAl= 49,091%
b) V(H2,đktc)=0,4.22,4=8,96(l)
c) nAl2(SO4)3= 0,5y=0,5.0,2=0,1(mol)
nFeSO4=x=0,1(mol)
Vddsau=VddH2SO4=0,2(l)
=>CMddAl2(SO4)3= 0,1/0,2=0,5(M)
CMddFeSO4=0,1/0,2=0,5(M)

a, Theo ĐLBTKL ta có: \(m_{O_2}=28,4-15,6=12,8\left(g\right)\Rightarrow n_{O_2}=\dfrac{12,8}{32}=0,4\left(mol\right)\)
PTHH: 4Al + 3O2 ---to→ 2Al2O3
Mol: x 0,75x
PTHH: 2Mg + O2 ---to→ 2MgO
Mol: y 0,5y
Ta có: \(\left\{{}\begin{matrix}27x+24y=15,6\\0,75x+0,5y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,4\\y=0,2\end{matrix}\right.\)
\(m_{Al}=0,4.27=10,8\left(g\right)\Rightarrow\%m_{Al}=\dfrac{10,8.100\%}{15,6}=69,23\%\)
\(m_{Mg}=15,6-10,8=4,8\left(g\right)\Rightarrow\%m_{Mg}=\dfrac{4,8.100\%}{15,6}=30,77\%\)
b, \(V_{O_2}=0,4.22,4=8,96\left(l\right)\)

Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{12,32}{22,4}=0,55\left(mol\right)\)
PTHH:
Mg + H2SO4 ---> MgSO4 + H2
a-------------------------------->a
Fe + H2SO4 ---> FeSO4 + H2
b------------------------------->b
=> Hệ pt \(\left\{{}\begin{matrix}24a+56b=22,8\\a+b=0,55\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,25\left(mol\right)\\b=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,25.24=6\left(g\right)\\m_{Fe}=0,3.56=16,8\left(g\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{6}{6+16,8}.100\%=26,31\%\\\%m_{Fe}=100\%-26,31\%=73,69\%\end{matrix}\right.\)

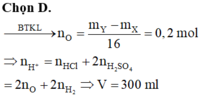
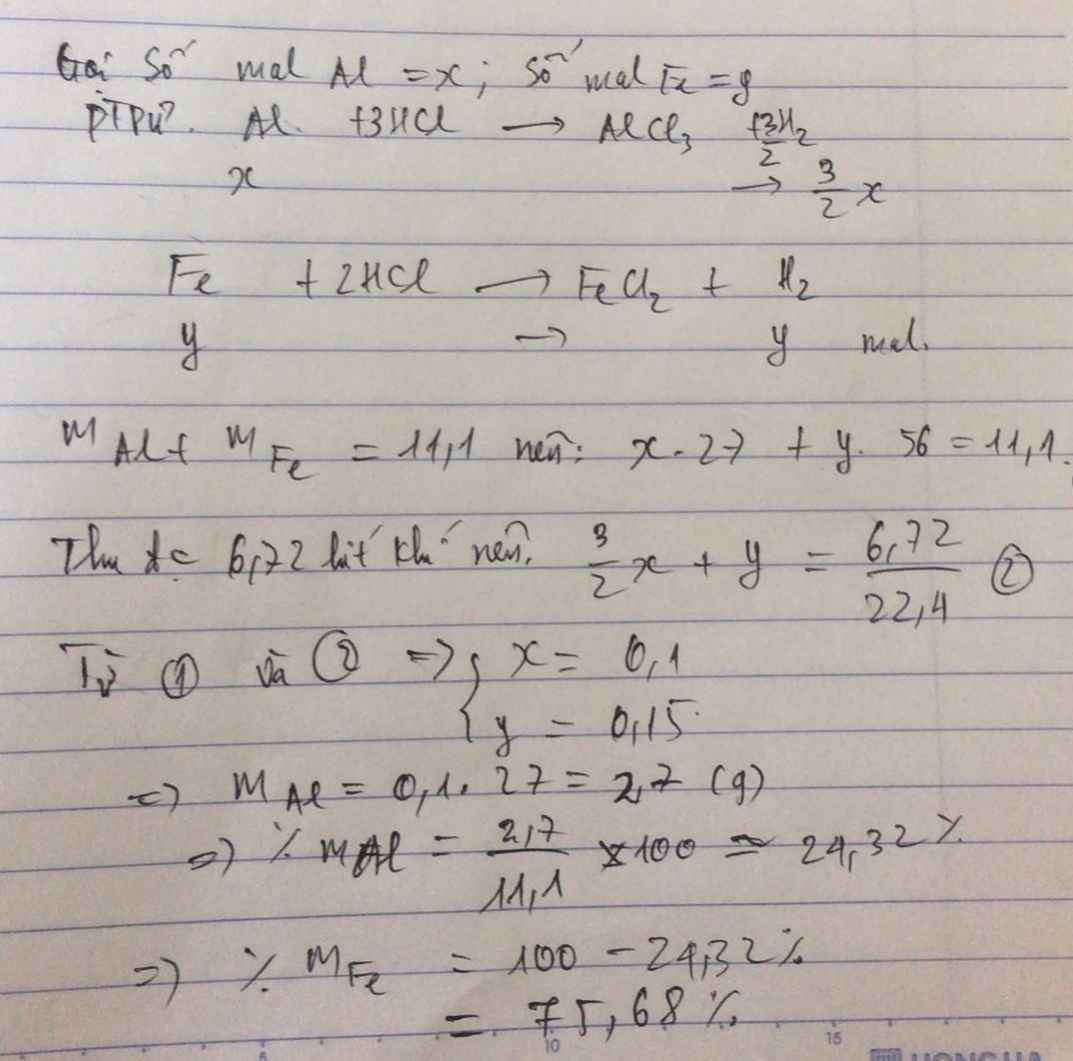


gọi a, là số mol của Mg và Fe
PTHH: 2Mg+O2=>2MgO
a------a/2------>a
2Fe+O2=>2FeO
b--------b/2----->b
theo đề ta có hpt: \(\begin{cases}40a+68b=12\\24a+56b=8\end{cases}\)
<=>\(\begin{cases}a=\frac{4}{19}\\b=\frac{1}{19}\end{cases}\)
=> V=(4/19+1/19).22,4=5,9ml
mMg=4/19.24=5,1g
=> %Mg=\(\frac{5,1}{8}.100=63,75\%\)
%Fe=100-63,75=36,25%