1. Cấu hình electron của ion nào dưới đây giống khí hiếm? (Biết: 13Al; 26Fe; 29Cu; 30Zn).
A. Zn2+. B. Fe3+. C. Al3+. D. Cu2+.
2. Nguyên tử của nguyên tố X tạo ra ion X3-. Tổng số hạt (p, n, e) trong X3- bằng 49, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 17. Số nơtron của ion X3- là
A. 15. B. 18. C. 16. D. 17.




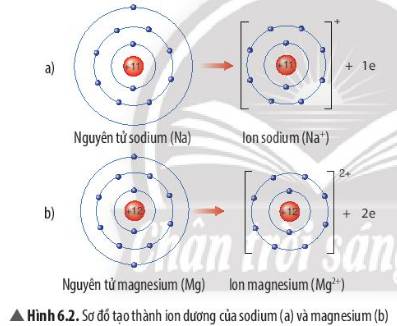
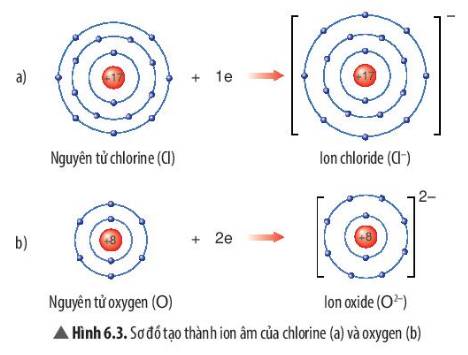

1. Cấu hình electron của ion nào dưới đây giống khí hiếm? (Biết: 13Al; 26Fe; 29Cu; 30Zn).
A. Zn2+. B. Fe3+. C. Al3+.(1s22s22p6 ) D. Cu2+.
2. Nguyên tử của nguyên tố X tạo ra ion X3-. Tổng số hạt (p, n, e) trong X3- bằng 49, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 17. Số nơtron của ion X3- là
A. 15. B. 18. C. 16. D. 17.
Gọi các hạt proton, nơtron và electron trong X lần lượt là p, n và e
Tổng số các loại hạt proton, nơtron và electron của X3- là 49
p+ n + e +3 = 49 hay 2p + n = 46 (1)
Tổng số hạt mang điện nhiều hơn hạt không mang điện là 17
p + e + 3 – n = 17 hay 2p -n = 14 (2)
Từ (1), (2) ta có p = e = 15, n =16
Vậy X là photpho.
Câu 1 : C
Giống câu hình khí hiếm Neon
Câu 2 :
Gọi số hạt proton, notron lần lượt là p và n
Ta có:
2p + n + 3 = 49
2p + 3 - n = 17
Suy ra p = 15 ; n = 16
Đáp án C