bài 1: cho các hóa chất sau đây:CaO, dung dịch HCl,\(KClO_3\), \(H_2O,Zn,P_2O_5.\)
a.hai hóa chất nào ở trên dùng để điều chế khí \(O_2\)trong phòng thí nghiệm? viết phương trình hóa học của phản ứng
b.hai hóa chất nào ở trên dùng để điều chế khí \(H_2\)trong phòng thí nghiệm? viết phương trình hóa học của phản ứng.
c. hai hóa chất nào ở trên khi cho tác dụng với nhau tạo ra \(Ca\left(OH\right)_2\)? viết phương trình hóa học của phản ứng.
d.hai hóa chất nào ở trên khi cho tác dụng với nhau tạo ra \(H_3PO_4?\) ? viết phương trình hóa học của phản ứng.



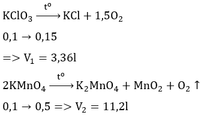
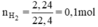

a. Chất dùng để điều chế O2 trong phòng thí nghiệm là KClO3
PTHH : 2KClO3 -> 2KCl + 3O2 <ở to>
b. Chất dùng để điều chế H2 trong phòng thí nghiệm là :HCl, Zn <Ko bt câu này đúng ko>
PTHH: Zn + 2HCl -> ZnCl2 + H2
c. Hai chất tác dụng với nhau tạo ra Ca<OH>2 là : CaO và H2O
PTHH: CaO + H2O -> Ca<OH>2
d. Hai chất tác dụng với nhau tạo ra H3PO4 là : P2O5 và H2O
PTHH: P2O5 + 3H2O -> 2H3PO4
Mình thay dấu ngoặc đơn thành dấu ngoặc kép, vì mình ko ghi đc. Bn thông cảm nha.