Cho 33,4 gam hỗn hợp gồm nhôm và sắt tác dụng vừa đủ với 800 gam dung dịch HCL. Sau phản ứng kết thúc thu được 17,92 lít khí (ở đktc)
a, Viết các phương trình hóa học
b, Tính thành phần phần trăm mỗi kim loại trong hỗn hợp
c, Tính nồng độ phần trăm của dung dịch HCl đã dùng
d, Tính nồng độ phần trăm của các chất tan trong dung dịch sau phản ứng


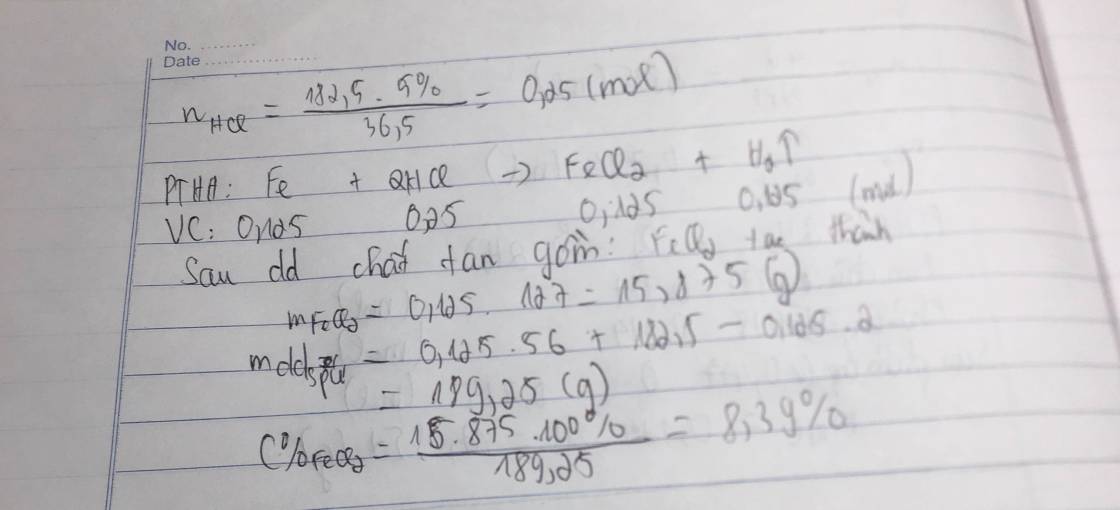

Gọi số mol Al : xmol ; Fe: y mol
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
x______________x_____3/2x
Fe + HCl \(\rightarrow\) FeCl2 +H2
y____________y__ y
nH2 =\(\frac{17,92}{22,4}\)=0,8mol
Ta có hệ 27x +56y=33,4
3/2x+y=0,8
\(\rightarrow\)x=0,2 ; y=0,5
%mAl = \(\frac{\text{0,2.27}}{33,4}.100\%\)=16,18%
%mFe=100-16,18=83,82%
nHCl =2nH2=0,8.2=1,6mol
C%HCl = \(\frac{\text{1,6.36,5}}{800}.100\%\)=7,3%
mddsau p/u = 33,4+800-0,8.2=831,8g
C%AlCl3=m/mdd.100=0,2.(27+35,5.3)/831,8.100=3,21%
C%FeCl2=m/mdd.100=0,5.(56+35,5.2)/831,8.100=7,63%