Nêu tính chất hóa học của oxi, mỗi tính chất viết 1 PTHH minh họa
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt.
Cu + O2 \(\Rightarrow t^o\)\(2CuO\)\(\)
- Tác dụng với hiđro, phản ứng có thể gây nổ mạnh nếu tỉ lệ thể tích O2 : H2 = 1:2
2H2 + O2 \(2H_2O\)
- Tác dụng với một số phi kim khác:
4P + 5O2 \(\rightarrow t^o\)\(2P_2O_5\)
+ Tác dụng với một số hợp chất:
2C2H6 + 7O2 \(\rightarrow t^o4CO_2\)\(+6H_2O\)

- Tác dụng được với nhiều phi kim (trừ Cl2, Br2, I2, F2,...)
\(Si+O_2\underrightarrow{t^o}SiO_2\\ 4P+5O_2\underrightarrow{t^o}2P_2O_5\)
- Tác dụng được với nhiều kim loại (trừ Ag, Pt, Au,...)
\(2Mn+O_2\underrightarrow{t^o}2MnO\\ 4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
- Tác dụng được với nhiều hợp chất:
\(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\uparrow\\ 2SO_2+O_2\xrightarrow[V_2O_5]{t^o}2SO_3\)

REFER
Khí oxi là một đơn chất phi kim rất hoạt động, đặc biệt ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nguyên tố oxi có hóa trị II.
Cụ thể:
- Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt.
Ví dụ:
- Tác dụng với hiđro, phản ứng có thể gây nổ mạnh nếu tỉ lệ thể tích O2 : H2 = 1:2
Phương trình hóa học:
- Tác dụng với một số phi kim khác:
Ví dụ:
+ Tác dụng với một số hợp chất:
Ví dụ:

Tác dụng với 1 số kim loại:
PTHH: 2K + 2 H2O → 2KOH + H2
Tác dụng với 1 số oxit bazơ:
PTHH: CaO + H2O → Ca(OH)2
Tác dụng với 1 số oxit axit:
PTHH: SO3 + H2O → H2SO4
2M + 2nH2O → 2M(OH)n + nH2↑
Ví dụ:
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Kim loại Mg tan rất chậm trong nước nóngMột số kim loại trung bình như Mg, Al, Zn, Fe…phản ứng được với hơi nước ở nhiệt độ cao tạo oxit kim loại và hiđroVí dụ:
Mg + H2Ohơi →MgO + H2
3Fe + 4H2Ohơi → Fe3O4+ 4H2
Fe + H2Ohơi → FeO + H2
2. Nước tác dụng với oxit bazoNước tác dụng với oxit bazơ tạo thành dung dịch bazo tương ứng.
H2O + Oxit bazơ→ Bazơ
Na2O + H2O → 2NaOH
Li2O +H2O→ 2LiOH
K2O +H2O→ 2KOH
CaO + H2O → Ca(OH)2
3. Nước tác dụng với oxit axitNước tác dụng với oxit axit tạo thành axit tương ứng.
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3

Câu 1:
+ Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt
+ Tác dụng với Hiđro, Phản ứng có thể gây nổ mạnh nếu tỉ lệ phản ứng O2:H2 = 1:2
+ Tác dụng với một số phi kim khác:
+ Tác dụng với một số hợp chất:
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.

Tham khảo:
- Nước tác dụng với kim loại:Nước tác dụng được với một số kim loại ở nhiệt độ thường như: Li, Na, K, Ca… tạo thành bazơ và khí H2.
Ví dụ:
2Na + 2H2O → 2NaOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
- Nước tác dụng với oxit bazơ:Nước tác dụng với một số oxit bazơ như Na2O, K2O, CaO … tạo thành dung dịch bazơ tương ứng. Dung dịch bazơ làm quỳ tím hóa xanh.
Ví dụ: Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
- Nước tác dụng với oxit axit:Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
Ví dụ:
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4

- Tác dụng với kim loại:
Nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
- Tác dụng với một số oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
\(K_2O+H_2O\rightarrow2KOH\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
- Tác dụng với oxit axit như SO3, P2O5… tạo thành axit tương ứng H2SO4, H3PO4,…
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)

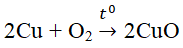
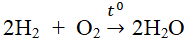
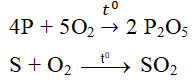
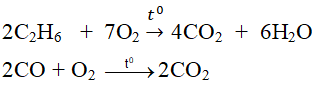


Oxi tác dụng với khá nhiều phi kim trong tự nhiên và với những điều kiện khác nhau. Tuy nhiên trong chương trình hóa học 8 thì hai nguyên tố chúng ta cần nắm vững đó là: Ni-tơ (N) và Phốt-pho(P)
Tác dụng với lưu huỳnh (S)
Thực hiện thí nghiệm đốt cháy lưu huỳnh trong không khí ta rút ra một số kết luận sau:
Oxi tác dụng với kim loạiKhác với phi kim, oxi khá kén chọn và khó xảy ra hơn. Tuy nhiên khi phản ứng với kim loại, Oxi phản ứng hầu hết và xảy ra kể cả trong điều kiện phức tạp cũng như điều kiện bình thường. Đương nhiên điều kiện bình thường phản ứng sẽ xảy ra lâu hơn - gỉ sắt là một minh chứng cho ví dụ trên. Ta cùng tìm hiểu phương trình hóa học của loại phản ứng này:
Đặc biệt lưu ý: là hợp chất biểu diễn chung cho Sắt II và Sắt III và được gọi bởi cái tên: Oxit sắt từ
là hợp chất biểu diễn chung cho Sắt II và Sắt III và được gọi bởi cái tên: Oxit sắt từ
Oxi tác dụng với hợp chấtNgoài đời thực ta thường thấy rất nhiều phản ứng của oxi với hợp chất. Tuy nhiên phổ biến nhất vẫn là phản ứng cháy của khí metan (có trong bùn ao, khí bioga) với oxi, tỏa nhiều nhiệt:
trinh gia long thiếu hợp chất em ơi