Kim loại (có hóa trị không đổi) trong muối sunfat chứa 40% về khối lượng.Không cần xác định tên kim loại, hãy tính phần trăm theo khối lượng của kim loại đó trong hợp chất với oxi.
giúp vs ạ, mk cần gấp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Gọi kim loại đó là A có hóa trị x ,.
=> Muối sunfat là : \(A_2\left(SO_4\right)_x\), oxit là : \(A_2O_x\)
=> \(\%M_A=\frac{M_A}{M_M}.100\%=\frac{2M_A}{2M_A+96x}=40\%=0,4\)
=> \(0,8M_A+38,4x=2M_A\)
=> \(1,2M_A=38,4x\)
=> \(M_A=32x\)
Ta có : \(\%M_A=\frac{2M_A}{2M_A+16x}.100\%\)
=> \(\%M_A=\frac{2.32x}{2.32x+16x}.100\%=\frac{64x}{80x}.100\%=80\%\)
Vậy ...
muối sunfat chiếm 40% chứ đâu phải kim loại đâu ?
mình cũng k bt nữa nhưng mình mong bạn xem lại đề

CTHH muối cacbonat: R2(CO3)n
CTHH muối photphat: R3(PO4)n
Xét R2(CO3)n
\(\%R=\dfrac{2.M_R}{2.M_R+60n}.100\%=40\%\)
=> 2.MR = 0,8.MR + 24n
=> 1,2.MR = 24n
=> \(M_R=20n\) (g/mol)
Xét R3(PO4)n
\(\%R=\dfrac{3.M_R}{3.M_R+95n}.100\%=\dfrac{3.20n}{3.20n+95n}.100\%=38,71\%\)

Gọi hóa trị của M là n
Gọi nMg = x mol ⇒ nFe = 3.x mol
Số mol H2 là: nH2 = 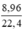 = 0,4 (mol)
= 0,4 (mol)
Số mol Cl2 là: nCl2 = 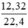 = 0,55 (mol)
= 0,55 (mol)
Các PTHH
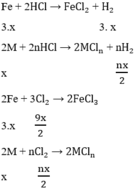
Theo bài ra ta có hệ phương trình:
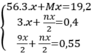
Giải hệ pt ⇒ x = 0,1 mol ⇒ n = 2 ⇒ M = 24
Vậy M là Mg
nMg = 0,1 mol ⇒ nFe = 0,3 mol
Thành phần % theo khối lượng
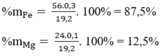

M(X)/M(SO4)=7/12
<=>M(X)/96=7/12
=>M(X)=(96.7)/12=56
=>X là sắt (Fe=56)
=>CTHH muối: FeSO4 (muối sắt (II) sunfat

Câu 1 :
Gọi CTHH muối là $M_3(PO_4)_2$
$\%P = \dfrac{31.2}{3M + 95.2}.100\% = 20\%$
$\Rightarrow M = 40(Ca)$
Vậy muối là $Ca_3(PO_4)_2$
Câu 2 :
Gọi CTHH muối là $M_3(PO_4)_2$
$\%M = \dfrac{3M}{3M + 95.2}.100\% = 38,7\%$
$\Rightarrow M = 40(Ca)$
Trong $CaCO_3$, $\%Ca = \dfrac{40}{100}.100\% = 40\%$

- Gọi công thức chung của hai muối là : \(M_2\left(SO_4\right)_n\)
\(PTHH:M_2\left(SO_4\right)_n+nBaCl_2\rightarrow nBaSO_4+2MCl_n\)
................0,03/n..................................0,03................
\(\Rightarrow\dfrac{0,03}{n}=\dfrac{3,82}{2M+96n}\)
\(\Rightarrow M=\dfrac{47}{3}n\)
Mà \(1< n< 2\)
\(\Rightarrow\dfrac{47}{3}< \dfrac{47}{3}n< \dfrac{94}{3}\)
\(\Rightarrow\dfrac{47}{3}< M< \dfrac{94}{3}\)
Nên A và B có thể là : Na và Mg .
- Gọi Na2SO4 và MgSO4 có mol là a, b .
b, \(BT_{SO_4^{-2}}=a+b=0,03\)
\(PTKL:142a+120b=3,82\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,01\\b=0,02\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Na2SO4}=1,42g\\m_{MgSO4}=2,4g\end{matrix}\right.\)
a, \(m_{MCl}=m_{NaCl}+m_{MaCl2}=2,485g\)
Câu b á thiếu dữ kiện nhe (mk bổ sung thêm là 2 kl này phải cùng vị trị chu kì )
a) PTHH: A2SO4+BaCl2 \(\rightarrow\) 2ACl+BaSO4
BSO4+BaCl2 \(\rightarrow\) BCl2+BaSO4
nBaCl2 = nBaSO4 = \(\dfrac{6.99}{233}\) = 0,03mol
\(\Rightarrow\)mBaCl2 = 0,03.208 = 6,24g.
b)mhh =3,82g
nSO4(2-)=0,03mol
-Nếu hh chỉ có A2SO4, MA2SO4\(=\dfrac{3,82}{0,03}=127,33\rightarrow M_A=15,67\)
-Nếu hh chỉ có BSO4, MBSO4\(=\dfrac{3,82}{0,03}=127,33\rightarrow M_B=31,33\)
Mà hh có cả A2SO4 và BSO4 nên
15,67 Mà A,B ở cùng chu kỳ nên A là Na (23) và B là Mg (24)

1) CTHH: \(A_2\left(SO_4\right)_x\)
Có \(\%A=\dfrac{2.M_A}{2.M_A+96x}.100\%=28\%\)
=> 1,44.MA = 26,88x
=> MA = \(\dfrac{56}{3}x\left(g/mol\right)\)
- Xét x = 1 => \(M_A=\dfrac{56}{3}\left(L\right)\)
- Xét x = 2 => \(M_A=\dfrac{112}{3}x\left(L\right)\)
- Xét x = 3 => MA = 56 (Fe)
=> CTHH: Fe2(SO4)3
2) Gọi khối lượng dd H3PO4 là m (g)
=> \(m_{H_3PO_4\left(bd\right)}=\dfrac{24,5.m}{100}=0,245m\left(g\right)\)
\(n_{P_2O_5}=\dfrac{71}{142}=0,5\left(mol\right)\)
PTHH: P2O5 + 3H2O --> 2H3PO4
0,5--------------->1
=> \(m_{H_3PO_4\left(saupư\right)}=0,245m+98\left(g\right)\)
mdd sau pư = m + 71 (g)
=> \(C\%_{dd.sau.pư}=\dfrac{0,245m+98}{m+71}.100\%=49\%\)
=> m = 258 (g)
Ủa, là hóa mà?