Hòa tan hoàn toàn hỗn hợp X gồm 0,4 mol FeO và 0,1 mol Fe2O3 vào dung dịch HNO3 loãng, dư thu được dung dịch A và khí NO (duy nhất). Dung dịch A cho tác dụng với dung dịch NaOH dư thu được kết tủa. Lấy toàn bộ kết tủa nung trong không khí đến khối lượng không đổi thu được chất rắn có khối lượng là ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sản phẩm cuối cùng sẽ chỉ có Fe2O3, bảo toàn Fe
=> n Fe2O3 = 0,45=> m = 72 gam
=> Đáp án D

Số mol Al là: ![]()
Trộn Al và X không có phản ứng hóa học xảy ra ![]()
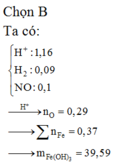
*Xét giai đoạn dung dịch Z tác dụng với AgNO3 dư:
Dung dịch Z tác dụng với AgNO3 thu được khí NO => Z chứa Fe2+ và H+ (*)
Z chứa Fe2+ và H+ => Z không chứa N O 3 - (**)
Từ (*) và (**) => Dung dịch Z gồm: ![]()
Các phản ứng tạo kết tủa:
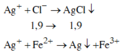
=> Kết tủa: 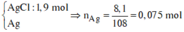
Các quá trình nhường, nhận electron:
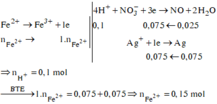
![]()
![]()
![]()
![]()
*Xét giai đoạn Y tác dụng với dung dịch HCl, HNO3:
Sơ đồ phản ứng:
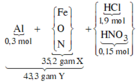
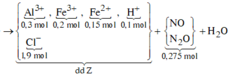
![]()
![]()
![]()
![]()
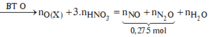
![]()
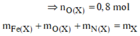
![]()
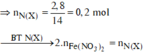
![]()
![]()
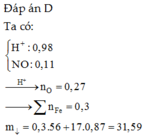
Đáp án B.

Theo gt ta có: $n_{NO}=0,015(mol);n_{NaOH}=0,45(mol);n_{Fe_2O_3}=0,05(mol)$
Quy hỗn hợp về Fe và O
Bảo toàn e ta có: $n_{O}=0,1275(mol)$
Ta có: $n_{n_{Fe(OH)_3}=0,3(mol)\Rightarrow n_{H^+/du}=0,15(mol)$
Dùng phương trình $H^+$ ta được $n_{HNO_3}=0,465(mol)$
$\Rightarrow \%m_{HNO_3}=46,5\%$
n Fe2O3 = 8/160 = 0,05(mol)
=> n Fe(OH)3 = 2n Fe2O3 = 0,1(mol)
Ta có :
n NaOH = n HNO3(dư) + 3n Fe(OH)3
=> n HNO3 dư = 0,45 - 0,1.3 = 0,15(mol)
n NO = 0,015(mol)
Bảo toàn electron :
3n Fe = 2n O + 3n NO
<=> n O = (0,1.3 - 0,015.3)/2 = 0,1275(mol)
Phân bổ H+ :
n HNO3 = n HNO3 pư + n HNO3 dư = 2n O + 4n NO + n HNO3 dư
= 0,1275.2 + 0,015.4 + 0,15 = 0,465(mol)
C% HNO3 = 0,465.63/63 .100% = 46,5%

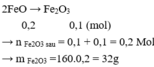

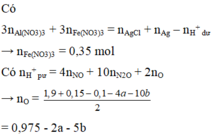
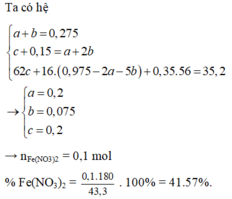
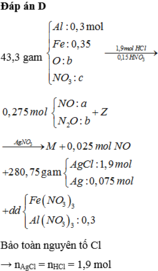

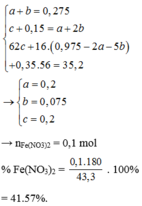



Áp dụng ĐLBTNT:
- \(n_{FeO}+2.n_{Fe_2O_3}\) (trc pư) = \(2.n_{Fe_2O_3}\) (sau pư)
=> \(n_{Fe_2O_3}=0,3\left(mol\right)\)
=> \(m_{Fe_2O_3}\) (sau pư) = 0,3.160=48 (g)