Khi oxi hoá hoàn toàn 50 gam glucozơ sẽ toả ra nhiệt lượng là 146,3 kJ. Hỏi khi oxi hoá hoàn toàn 1 mol glucozơ sẽ toả ra nhiệt lượng là bao nhiêu ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cứ 1g chất béo khi bị oxi hóa hoàn toàn tỏa ra 38kJ
Vậy 15g chất béo khi bị oxi hóa hoàn toàn tỏa ra x kJ
x = 15.38/1 = 570kJ

Số mol của axetilen là :
11,2/22,4 x 20/100 = 0,1 mol
Số mol của etilen là :
11,2/22,4 x 80/100 = 0,4 mol
Vậy nhiệt lượng toả ra khi đốt là
(0,1 x 1320) + (0,4 x 1423) = 701,2 (kJ).

Nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 kg etilen là :
1423/28 x 1000g = 50821,4kJ
Nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 kg axetilen là :
1320/26 x 10006 = 50769,2kJ

\(n_{CH_4} = \dfrac{11,2.90\%}{22,4}= 0,45\ mol\)
Nhiệt lượng tỏa ra :
\(Q = 783.0,45 = 325,35\ KJ/mol\)
Thể tính khí metan CH4 = 11,2.90% = 10,08 lít
=> nCH4 = \(\dfrac{10,08}{22,4}\) = 0,45 mol
1 mol metan khi cháy tỏa ra nhiệt lượng là 783 kj
=> Khi đốt cháy 0,45 mol metan hay 11,2 lít khí bioga thì nhiệt lượng tỏa ra = 783.0,45= 352,35 kj

Đáp án C
Ta có: Nhiệt lượng toả ra khi nhiên liệu bị đốt cháy 12kg12kg than bùn là: Q = qm = 1 , 4 . 10 7 . 12 = 168 . 10 6 J

C.
Điểm giống nhau giữa sự cháy và sự oxi hóa chậm: đều là sự oxi hóa có tỏa nhiệt.
Điểm khác nhau giữa sự cháy và sự oxi hóa chậm: sự oxi hóa chậm không phát sáng còn sự cháy có phát sáng.

1. Trong 1000 m 3 khí thiên nhiên có 850 m 3 C H 4
2 C H 4 → 1500 ° C C 2 H 2 + 3 H 2
CH ≡ CH + HCl → 150 - 200 ° C , H g C l 2 C H 2 = C H - C l
Khối lượng vinyl clorua thu được (nếu hiệu suất các quá trình là 100%) là:
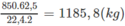
Với hiệu suất cho ở đầu bài, khối lượng vinyl clorua là:
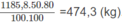
2. Nhiệt lượng cần dùng để làm nóng 100 lít nước từ 20 ° C lên 100 ° C :
100.4,18.(100 - 20) = 33440 (kJ)
Vì 20% nhiệt lượng đã toả ra môi trường nên nhiệt lượng mà khí thiên nhiên cần cung cấp phải là :
Đặt số mol C 2 H 6 tà x thì số mol C H 4 là 85. 10 - 1 x.
Ta có 1560x + 88085. 10 - 1 x = 41800
x = 462. 10 - 2
Thể tích khí thiên nhiên cần dùng:
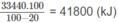

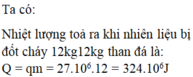


n C 6 H 12 O 6 = 50/180 ≈ 0,278 mol
Cứ 0,278 mol glucozơ khi oxi hóa hoàn toàn thì tỏa ra 146,3kJ
Vậy 1 mol → x? kJ
x = 146,3/0278 = 526,3kJ