Cho x mol Fe tan hoàn toàn trong dung dịch chứa y mol H2SO4 (tỉ lệ x : y = 2 : 5), thu được một sản phẩm khử duy nhất và dung dịch chỉ chứa muối sunfat. Số mol electron do lượng Fe trên nhường khi bị hoà tan là
A. 3x
B. y.
C. 2x
D. 2y


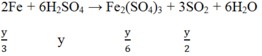
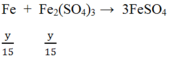
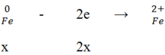






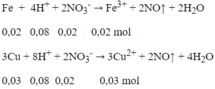
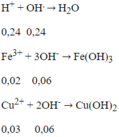
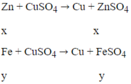
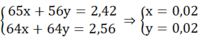


Đáp án B