Khi cho 3,00 g hỗn hợp Cu và Al tác dụng với dung dịch HNO3 đặc dư, đun nóng, sinh ra 4,48 lít khí duy nhất NO2 (đktc). Xác định phần trăm khối lượng của mỗi kim loại trong hỗn hợp?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi $n_{Cu} = a(mol) ; n_{Al} = b(mol) \Rightarrow 64a + 27b = 3(1)$
$Cu^0 \to Cu^{+2} + 2e$
$Al^0 \to Al^{+3} + 3e$
$N^{+5} + 1e \to N^{+4}$
Bảo toàn electron :
$2a + 3b = 0,2(2)$
Từ (1)(2) suy ra $a = \dfrac{3}{115} ; b = \dfrac{17}{345}$
\(\%m_{Cu}=\dfrac{\dfrac{3}{115}.64}{3}.100\%=55,65\%\\ \%m_{Al}=100\%-55,65\%=44,35\%\)
Gọi số mol của Cu và Al lần lượt là x,y (mol) (x,y>0)
\(Cu+4HNO_{3\left(đ\right)}\underrightarrow{to}Cu\left(NO_3\right)_2+2NO_2+2H_2O\\ x..................................2x\left(mol\right)\\ Al+6HNO_{3\left(đ\right)}\underrightarrow{to}Al\left(NO_3\right)_3+3NO_2+3H_2O\\ y...............................3y\left(mol\right)\)
\(\left\{{}\begin{matrix}64x+27y=3\\2x+3y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=\dfrac{3}{115}\\y=\dfrac{17}{345}\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{\dfrac{3}{115}.64}{3}.100\approx55,652\%\\\%m_{Al}\approx44,348\%\end{matrix}\right.\\ \)

Đáp án : A
P1 : ne trao đổi = nNO2 = 0,47 mol
P2 : ne trao đổi = nCl2 .2 => nCl2 pứ = 0,235 mol
=> mKL = mmuối – mCl2 pứ = 11,19g
=> m = 2.11,19 = 22,38g

\(3,68g\left\{{}\begin{matrix}Fe\\Mg\end{matrix}\right.+HNO3->\left\{{}\begin{matrix}Fe\left(NO3\right)3\\Mg\left(NO3\right)2\end{matrix}\right.+5,376\left(l\right)NO2\)
Bảo toàn e :
\(3x+2y=0,24\)
Ta có :
\(\left\{{}\begin{matrix}56x+24y=3,68\\3x+2y=0,24\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,04\left(mol\right)\\y=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%mFe=\dfrac{0,04.56}{3,68}=60,87\%\\\%mMg=\dfrac{0,06.24}{3,68}=39,13\%\end{matrix}\right.\)
Bảo toàn nguyên tố Fe và Mg :
\(nFe=nFe\left(NO3\right)3=0,04\left(mol\right)\)
\(nMg=nMg\left(NO3\right)2=0,06\left(mol\right)\)
Ta có : \(nHNO3pu=0,04.3+0,06.2=0,24\left(mol\right)\)
\(\Rightarrow mHNO3=0,24.63=15,12\left(g\right)\)

QT cho e: Xét với ½ khối lượng hỗn hợp
Mg→ Mg2++ 2e (1)
x 2x mol
Al→ Al3++ 3e (2)
y 3y mol
Cu→ Cu2++ 2e (3)
z 2z mol
→ne cho= 2x+ 3y+2z mol
QT nhận e:
-Phần 1: nNO2=0,47 mol
N+5+ 1e→ NO2
0,47 0,47 mol
Theo ĐL bảo toàn e: ne cho= 2x+ 3y+2z = ne nhận= 0,47
-Phần 2:
Cl2+ 2e→ 2Cl-
0,47 0,47
Theo ĐL bảo toàn e: ne cho= 2x+ 3y+2z = ne nhận= 0,47
mmuối clorua= mkim loại+ mCl-= mkim loại+ 0,47.35,5=27,875 → mkim loại=11,19 gam → m= 11,19.2=22,38 gam

Ag + 2HNO3 ⟶ AgNO3 + H2O + NO2
Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2
Gọi x,y lần lượt là số mol Ag, Cu
\(\left\{{}\begin{matrix}108x+64y=30\\x+2y=0,3\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,27\\y=0,016\end{matrix}\right.\)
=> \(\%m_{Cu}=\dfrac{0,016.64}{30}.100=3,41\%\)

nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g

a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + H2SO4 ---> FeSO4 + H2
0,2<---------------------------0,2
\(\rightarrow\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Cu}=16-11,2=4,8\left(g\right)\end{matrix}\right.\)
b, \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{32}{16}.0,2=0,4\left(mol\right)\\n_{Cu}=\dfrac{4,8}{64}.\dfrac{32}{16}=0,15\left(mol\right)\end{matrix}\right.\)
PTHH:
Cu + 2H2SO4 (đặc, nóng) ---> CuSO4 + SO2 + 2H2O
0,15--------------------------------------------->0,15
2Fe + 6H2SO4 (đặc, nóng) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,4------------------------------------------------------>0,6
=> VSO2 = (0,6 + 0,15).22,4 = 16,8 (l)
c, \(n_{NaOH}=0,375.2=0,75\left(mol\right)\)
\(T=\dfrac{0,75}{0,6+0,15}=1\) => tạo duy nhất muối axit (NaHSO3)
PTHH: NaOH + SO2 ---> NaHSO3
0,75----------------->0,75
=> mmuối = 0,75.104 = 78 (g)



Gọi nAl = x (mol), nCu = y (mol); nNO2 =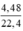 = 0,2 mol
= 0,2 mol
Theo pt: nNO2(1) = 3. nAl = 3.x mol
nNO2(2) = 2. nCu = 2y mol
⇒ Tổng nNO2 = 3x + 2y = 0,2 mol
Ta có hệ phương trình