Hòa tan hoàn toàn 2,96 gam hỗn hợp X gồm Fe, Zn, Al bằng dung dịch HCl dư, thu được 1,568 lít khí H 2 (đktc). Mặt khác, cho 2,96 gam X phản ứng hoàn toàn với khí C l 2 dư, thu được 8,64 gam muối. Khối lượng Al trong 2,96 gam X là
A. 0,54 gam.
B. 0,81 gam.
C. 0,27 gam.
D. 1,08 gam.


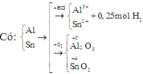
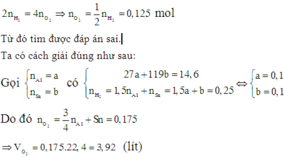


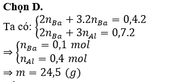

Chọn đáp án A