Cho m (g) Fe vào dung dịch chứa 1,38 mol HNO3, đun nóng đến kết thúc phản ứng còn 0,75m (g) chất rắn không tan và có 0,38 mol hỗn hợp khí NO, NO2 thoát ra ở (dktc). Giá trị của m là:
A. 70
B. 56
C. 84
D. 112
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Sau phản ứng Fe dư nên chỉ tạo muồi Fe(NO3)2.
Áp dụng sự bảo toàn khối lượng (số mol) N ta có:
![]()
Hay:
![]()
![]()
Vậy: mFe = 0,5.56 = m - 0,75m → m = 112 (g)

Đáp án D
Khối lượng Fe = 0,3m gam và khối lượng Cu = 0,7m gam
Sau phản ứng còn 0,75m gam → Fe chỉ phản ứng 0,25m gam; Fe dư vậy sau phản ứng chỉ thu được muối Fe2+.
Ta có:
![]()
Số mol của Fe(NO3)2 = 0,25m/56
Sơ đồ phản ứng:
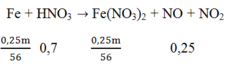
Áp dụng ĐLBT nguyên tố N ta có:
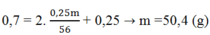

Đáp án B
Ta có:
![]()
mCu = 0,7m (g)
Vì Fe phản ứng trước Cu và sau khi phản ứng còn 0,75m (g) chất rắn → Cu chưa phản ứng 0,7m
Fe dư 0,75m - 0,7m = 0,05m → mFe pư = 0,2m - 0,05m = 0,25m (g)
Fe dư → Chỉ tạo muối Fe(NO3)2
HNO3 hết (Lưu ý chỉ H+ hết, NO3- còn trong muối).
Quá trình nhường electron:

Quá trình nhận electron:
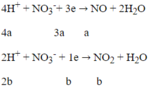
Áp dụng định luật bảo toàn electron:
![]()
→ m = 50,4

MY= 24,4 → Y chứa H2. Khí không màu hóa nâu ngoài không khí là NO → Y chứa NO và H2.
Gọi x và y lần lượt là số mol của H2 và NO
Ta có: x+ y= 0,125; 2x+ 30y= 0,125.24,4 → x= 0,025; y= 0,1
Vì có khí H2 thoát ra và Zn dư → H+ và NO3- hết → Muối thu được là muối clorua
Do nNO3(-)ban đầu= 0,15 mol > nNO= 0,1 mol→ X chứa NH4+
Theo bảo toàn nguyên tố N → nNH4+= 0,15-0,1= 0,05 mol
Theo bảo toàn electron: 2.nZn pứ= 3.nNO+ 8nNH4++ 2nH2= 0,75 mol→ nZn pứ= nZn2+= 0,375 mol
→mmuối= mZnCl2+ mNH4Cl+ mNaCl+ mKCl= 136. 0,375+ 53,5.0,05+ 58,5.0,05+ 74,5.0,1= 64,05 gam
Đáp án A

Đáp án : C
Fe được hòa tan hoàn toàn bởi dd HNO3 thu được dd X, khi thêm HCl vào X có khí NO thoát ra → trong X có ion Fe2+ → HNO3 đã phản ứng hết
n(NO) = 1,12/22,4 = 0,05 mol
Fe + 4HNO3 → Fe(NO3)3 + NO + 4H2O
0,05 -> 0,2 -> 0,05
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
x -> 3x
Theo ĐL bảo toàn nguyên tố, số mol NO3- có trong muối:
n(NO3- trong muối) = n(HNO3) - n(NO) = 0,15 mol
n(NaOH) = 0,115.2 = 0,23 mol
Sau khi NaOH pư hoàn toàn với các chất trong dd Y, dung dịch thu được có:
n(Na+) = n(NaOH) = 0,23 mol; n(Cl-) = n(HCl) = 0,1 mol → n(NO3-) = n(Na+) - n(Cl-) = 0,23 - 0,1 = 0,13 mol → Số mol NO3- bị Fe2+ khử: 0,15 - 0,13 = 0,02 mol
NO3- + 3Fe2+ + 4H+ → 3Fe3+ + NO + 2H2O
0,02 -> 0,06 -> 0,08
NO3- và H+ đều dư (H+ dư 0,02mol) → Fe2+ đã phản ứng hết
→ 3x = 0,06 → x = 0,02 mol
Tổng số mol Fe: n(Fe) = 0,05 + x = 0,07 mol
Khối lượng Fe đã sử dụng: m(Fe) = 0,07.56 = 3,92g
Đáp án D
Sau phản ứng Fe dư nên chỉ tạo muối Fe(NO3)2.
F e + 4 H N O 3 → F e N O 3 3 + N O + 2 H 2 O F e + 2 F e N O 3 3 → 3 F e N O 3 2
Áp dụng sự bảo toàn khối lượng (số mol) N ta có:
n N t r o n g H N O 3 = n N t r o n g F e N O 3 2 + n N t r o n g N O , N O 2
Hay:
1 , 28 = 2 . n F e N O 3 2 + 0 , 38 ⇒ n F e N O 3 2 = 0 , 5 m o l = n F e p h ả n ứ n g
Vậy: mFe = 0,5.56 = m - 0,75m → m = 112 (g)