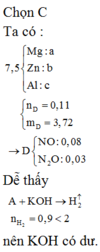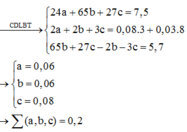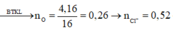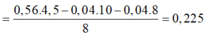Hỗn hợp bột A gồm 3 kim loại Mg, Zn, Al. Khi hoà tan hết 7,5g A vào 1 lít dung dịch HNO3 thu được 1lít dung dịch B và hỗn hợp khí D gồm NO và N2O. Thu khí D vào bình dung tích 3,20lít có chứa sẵn N2 ở 00C và 0,23atm thì nhiệt độ trong bình tăng lên đến 27,30C, áp suất tăng lên đến 1,10atm, khối lượng bình tăng thêm 3,72 gam. Nếu cho 7,5g A vào 1 lít dung dịch KOH 2M thì sau khi kết thúc phản ứng khối lượng dung dịch tăng thêm 5,7g. Tổng số mol 3 kim loại có trong A gần nhất với :
A. 0,15
B. 0,18
C. 0,21
D. 0,25