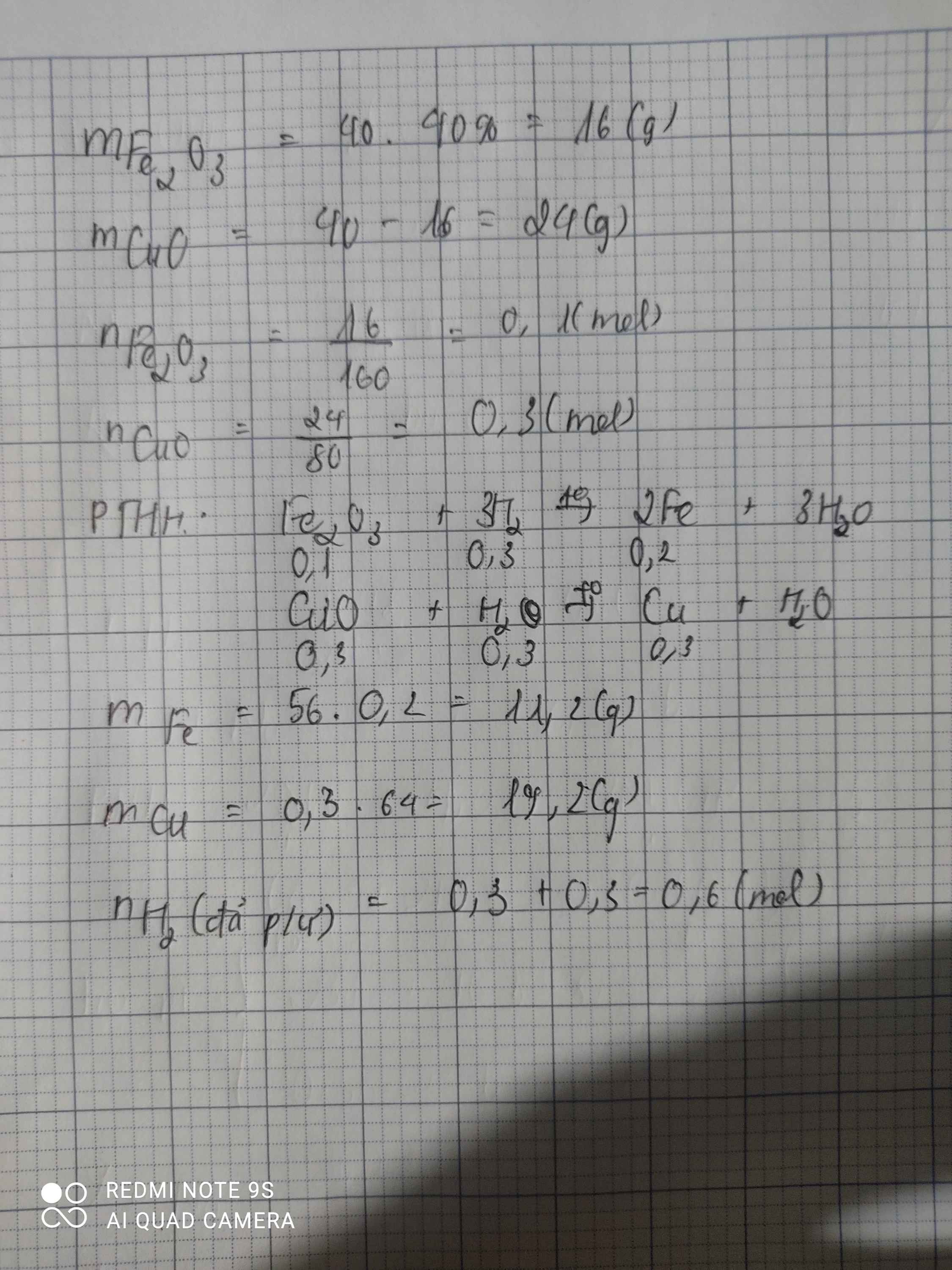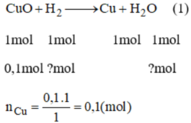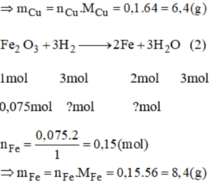Có một hỗn hợp gồm 60% F e 2 O 3 và 40% CuO. Người ta dùng H 2 ( dư) để khử 20g hỗn hợp đó. Tính số mol H 2 tham gia phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

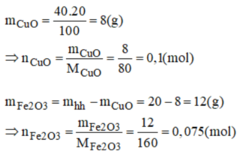


hỗn hợp 100% <=> 20g
1. fe2o3 60% <=> 12g <=> 0,075mol
cuo 40% <=> 8g <=> 0,1 mol
Ta có:
Fe2O3 + 3H2 --> 2Fe + 3H2O
mol: 0,075 0,225 0,15
CuO + H2 → Cu + H20
mol: 0.1 0.1 0.1
mFe= 0,15x56=8,4g. mCu=0,1x64= 6,4g
nH2= 0,225+0,1=0,325mol ==> V H2 = 0,325x 22,4 = 7,28 lít

Khối lượng Fe2O3 trong 20 gam hỗn hợp : \(20\cdot\dfrac{60}{100}=12\left(g\right)\)
\(\Rightarrow n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{12}{160}=0,075\left(mol\right)\)
Khối lượng CuO trong 20 gam hỗn hợp : \(\dfrac{20\cdot40}{100}=8\left(g\right)\)
\(\Rightarrow n_{CuO}=\dfrac{m}{M}=\dfrac{8}{80}=0,1\left(mol\right)\)
Phương trình phản ứng khử của H2 :
Fe2O3 + 3H2 \(\rightarrow\)2Fe + 3H2O
1---------3---------2
0,075-----0,225---0,15
Theo phương trình phản ứng trên , ta có : mFe = 0,15 . 56 = 8,4 ( g )
CuO + H2 \(\rightarrow\) Cu + H2O
1--------1------1
0,1------0,1-----0,1
Theo phương trình phản ứng trên : mCu = 0,1 . 64 = 6,4 ( gam )
a) Khối lượng Fe : 8,4 ( gam ) ; Khối lượng của Cu : 6,4 gam
b) Số mol H2 đã tham gia phản ứng : 0,225 + 0,1 = 0,325 ( mol )
\(m_{Fe_2O_3}=60\%.20=12\left(g\right)\)
\(n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\)
\(m_{CuO}=40\%.20=8\left(g\right)\)
\(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
Pt: \(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,075mol\(\rightarrow\)0,225mol\(\rightarrow\) 0,15mol
Pt: CuO + H2 \(\rightarrow\) Cu + H2O
0,1mol\(\rightarrow\)0,1mol\(\rightarrow\)0,1mol
a) \(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)
b) \(n_{H_2\left(pư\right)}=0,225+0,1=0,325\left(mol\right)\)

, PTHH :
Fe2O3 + 3H2 -> 2Fe + 3H2O
0,075......0,225.........0,15 (mol)
CuO + H2 -> Cu + H2O
0,1.......0,1......0,1 (mol)
mFe2O3 = 20.60%=12(g) => nFe2O3 = 0,075(mol)
mCuO = 8 ( g) => nCuO = 0,1(mol)
mFe = 0,15 .56=8,4(g)
mCu = 0,1 .64=6,4(g)
=>bạn llàm như ý đướiưới để tính % nhé

Ta có:
\n\n\\(\\%m_{Fe2O3}=60\\%.20=12\\left(g\\right)\\Rightarrow n_{Fe2O3}=\\frac{12}{160}=0,075\\left(mol\\right)\\)
\n\n\\(\\%m_{CuO}=40\\%.20=8\\left(g\\right)\\Rightarrow n_{CuO}=\\frac{8}{80}=0,1\\left(mol\\right)\\)
\n\n\\(Fe_2O_3+3H_2\\rightarrow2Fe+3H_2O\\)
\n\n_0,075__________0,15_____
\n\n\\(CuO+H_2\\rightarrow Cu+H_2O\\)
\n\n_0,1___________0,1_____
\n\n\\(\\left\\{{}\\begin{matrix}m_{Fe}=0,15.56=8,4\\left(g\\right)\\\\m_{Cu}=0,1.64=6,4\\left(g\\right)\\end{matrix}\\right.\\)
\n\n\\(\\Rightarrow\\left\\{{}\\begin{matrix}\\%m_{Fe}=\\frac{8,4}{8,4+6,4}.100\\%=56,76\\%\\\\\\%m_{Cu}=100\\%-56,76\\%=43,24\\%\\end{matrix}\\right.\\)
\n
\(m_{Fe_2O_3}=16\cdot75\%=12\left(g\right)\)
\(n_{Fe_2O_3}=\dfrac{12}{160}=0.075\left(mol\right)\)
\(n_{CuO}=16\cdot25\%=4\left(g\right)\)
\(n_{CuO}=\dfrac{4}{80}=0.05\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(n_{H_2}=3\cdot0.075+0.05=0.275\left(mol\right)\)
a,\(m_{Fe_2O_3}=16.75\%=12\left(g\right)\Rightarrow n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\)
\(m_{CuO}=16-12=4\left(g\right)\Rightarrow n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
PTHH: Fe2O3 + 3H2 → 2Fe + 3H2O
Mol: 0,075 0,225 0,15
PTHH: CuO + H2 → Cu + H2O
Mol: 0,05 0,05 0,05
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right);m_{Cu}=0,05.64=3,2\left(g\right)\)
b,\(n_{H_2}=0,225+0,05=0,275\left(mol\right)\)

PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
a, Ta có: \(\left\{{}\begin{matrix}m_{Fe_2O_3}=20.60\%=12\left(g\right)\Rightarrow n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\\m_{CuO}=20-12=8\left(g\right)\Rightarrow n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\end{matrix}\right.\)
Theo pT: \(\left\{{}\begin{matrix}n_{Fe}=2n_{Fe_2O_3}=0,15\left(mol\right)\\n_{Cu}=n_{CuO}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)
b, Theo PT: \(n_{H_2}=3n_{Fe_2O_3}+n_{CuO}=0,325\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,325.22,4=7,28\left(l\right)\)
Bạn tham khảo nhé!