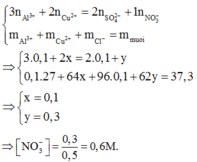Dung dịch X chứa các ion sau: Al3+, Cu2+, SO42- và NO3-. Để kết tủa hết ion SO42- có trong 250 ml dung dịch X cần 50 ml dung dịch BaCl2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NH3 dư thì thu được 7,8 gam kết tủa Làm bay hơi hết nước có trong 500 ml dung dịch X được 37,3 gam hỗn hợp muối khan. Nồng độ mol của NO3- trong dung dịch X là
A. 0,3M.
B. 0,6M
C. 0,2M
D. 0,4M