Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+ và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 133,84 gam kết tủa. Biết tỷ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3 : 2 : 1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu gần nhất với
A. 48%.
B. 58%.
C. 54%.
D. 46%.


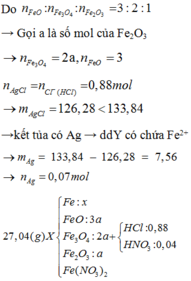
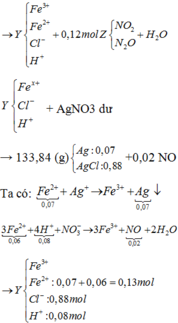

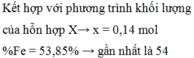


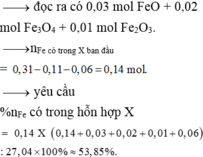





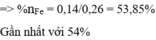





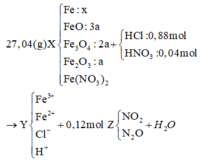


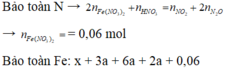

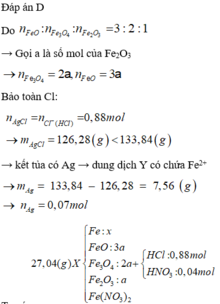
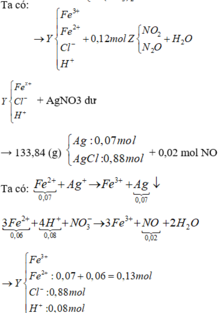


Đáp án C
Phân tích kết tủa:
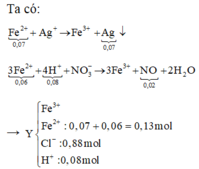
0,88 mol Cl → 0,88 mol AgCl → 133,84 gam kết tủa còn 0,07 mol Ag nữa.
AgNO3 + dung dịch Y → 0,02 mol NO chứng tỏ trong Y chứa 0,08 mol H+.
Thêm nữa, kết tủa có Ag → chứng tỏ trong Y có Fe2+ → Y không chứa NO 3 - .
Rõ hơn quan sát sơ đồ:
Theo đó, bảo toàn Ag có 0,95 mol AgNO3 → có 0,31 mol Fe(NO3)3.
→ Bảo toàn nguyên tố N có số mol Fe(NO3)2 trong X là 0,06 mol.
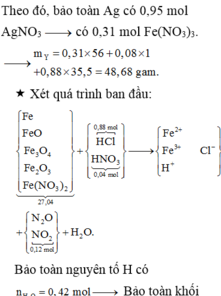
Nhìn 27,04 gam X gồm 0,31 mol Fe + 0,12 mol NO3 + ? mol O → ? = 0,14 mol.
Lại có tỉ lệ FeO : Fe3O4 : Fe2O3 = 3:2:1
→ viết gộp cụm: 3FeO.2Fe3O4.1Fe2O3 = Fe11O14.
→ từ 0,14 mol O suy ra có 0,01 mol Fe11O14.
→ đọc ra có 0,03 mol FeO + 0,02 mol Fe3O4 + 0,01 mol Fe2O3.
→ nFe có trong X ban đầu = 0,31 - 0,11 - 0,06 = 0,14 mol
→ yêu cầu %nFe có trong hỗn hợp X