Cho m gam hỗn hợp gồm Mg, Al và Zn phản ứng vừa đủ với 7,84 lít (đktc) khí Cl2. Cũng m gam hỗn hợp trên phản ứng vừa đủ với m1 gam dung dịch HCl 14,6%. Giá trị của m1 là
A. 87,5
B. 175,0
C. 180,0
D. 120,0
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Khi phản ứng với Cl2
n C l 2 = 7 , 84 22 , 4 = 0 , 35 ( m o l )
X – ne → X +n Cl2+ 2e→ 2Cl-
ne (KL nhường) = ne ( Cl2 nhận ) = 0,35.2 = 0,7 (mol)
Khi phản ứng với HCl
X – ne → X +n 2H+ + 2e → H2
ne( H+ nhận ) = ne (KL nhường) = 0,7 (mol)
=> nH+ = 0,7 (mol)
=> mHCl = 0,7.36,5 = 25,55 (g)
m d d H C l = m H C l . 100 % C % = 25 , 55 . 100 % 14 , 6 % = 175 ( g )

Chọn đáp án B
n C l 2 = x mol; n O 2 = y mol
⇒ x + y = 0,35 mol (1)
Áp dụng định luật bảo toàn khối lượng: m C l 2 + m O 2 = m Z – m Y = 19g
⇒ 71x + 32y = 19 (2)
Từ (1)(2) => x = 0,2; y = 0,15
Đặt n M g = a mol; n A l = b mol
⇒ 24a + 27b = 11,1g (3)
Bảo toàn e: 2 n M g + 3 n A l = 2 n C l 2 + 4 n O 2
⇒ 2a +3b = 1 (4)
Từ (3)(4) ⇒ a = 0,35; b = 0,1
⇒% m A l = 0 , 1 . 27 11 , 1 . 100 % = 23 , 32 %

Đáp án B.
Áp dụng định luật bảo toàn khối lượng:
![]()
= 30,1 - 11,1 = 19 gam
Đặt
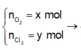
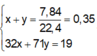
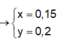
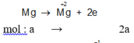
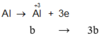
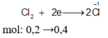
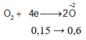
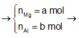
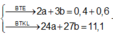
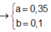
![]()

Chọn đáp án B
n X = 7 , 84 22 , 4 = 0,35 (mol)
Bảo toàn khối lượng: m C l 2 + m O 2 = 30,1 – 11,1 = 19 (gam)
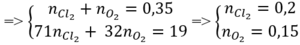

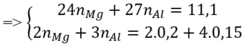
=> n M g = 0 , 35 n A l = 0 , 1 => %mAl = 0 , 1 . 27 11 , 1 .100% = 24,32%

\(n_{Cl_2}=a\left(mol\right)\)
\(n_{Mg}=b\left(mol\right)\)
\(n_X=a+b=\dfrac{7.84}{22.4}=0.35\left(mol\right)\left(1\right)\)
Bảo toàn khối lượng :
\(m_{Cl_2}+m_{O_2}=30.1-11.1=19\left(g\right)\)
\(\Leftrightarrow71a+32b=19\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.2,b=0.15\)
\(Đặt:\)
\(n_{Mg}=x\left(mol\right),n_{Al}=y\left(mol\right)\)
\(m_Y=24x+27y=11.1\left(g\right)\left(3\right)\)
Bảo toàn e :
\(2x+3y=0.2\cdot2+0.15\cdot4=1\left(4\right)\)
\(\left(3\right),\left(4\right):x=0.35,y=0.1\)
\(\%Mg=\dfrac{0.35\cdot24}{11.1}\cdot100\%=75.67\%\)
\(\%Al=24.33\%\)
Đáp án B