viết phương trình hóa học trong các trường hợp sau
a) Đốt cháy khí hiđro
b) chô một luồng khí hiđro đi qua bột đồng oxit đun nóng
c)Điều chế khí hiđro từ sắt và axit clohidri
các phản ứng trên thuộc loại phản ứng nào
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, PTHH:
Fe2O3 + 3H2 ---to---> 2Fe + 3H2O (1)
CuO + H2 ---to---> Cu + H2O (2)
b, nFe = \(\dfrac{2,8}{56}=0,05\left(mol\right)\)
nCu = \(\dfrac{6-2,8}{64}=0,05\left(mol\right)\)
Theo pt (1): nH2 (1) = 2nFe = 2 . 0,05 = 0,1 (mol)
Theo pt (2): nH2 (2) = nCu = 0,05 (mol)
=> VH2 = (0,1 + 0,05) . 22,4 = 3,36 (l)
c, Theo pt (1): nCuO = nCu = 0,05 (mol)
Theo pt (2): nFe2O3 = \(\dfrac{1}{2}n_{Fe}=\dfrac{1}{2}.0,05=0,025\left(mol\right)\)
=> m = 0,05 . 80 + 0,025 . 160 = 8 (g)
\(a.CuO+H_2-^{t^o}\rightarrow Cu+H_2O\\ Fe_2O_3+3H_2-^{t^o}\rightarrow2Fe+3H_2O\\ b.m_{Cu}=6-2,8=3,2\left(g\right)\\ n_{Cu}=0,05\left(mol\right);n_{Fe}=0,05\left(mol\right)\\ \Sigma n_{H_2}=n_{Cu}+\dfrac{3}{2}n_{Fe}=0,125\left(mol\right)\\ \Rightarrow V_{H_2}=2,8\left(l\right)\\ c.n_{CuO}=n_{Cu}=0,05\left(mol\right);n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,025\left(mol\right)\\ m_{hh}=m_{CuO}+m_{Fe_2O_3}=0,05.80+0,025.160=8g\)

a) Phương trình hóa học của các phản ứng:
H2 + CuO → Cu + H2O (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b) Trong phản ứng (1), (2) chất khử H2 vì chiếm oxi của chất khác, chất oxi hóa là CuO và Fe2O3 vì nhường oxi cho chất khác.
c) Khối lượng đồng thu được từ 6g hỗn hợp 2 kim loại thu được:
mCu = 6g - 2,8g = 3,2g, nCu = 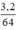 = 0,05 mol
= 0,05 mol
nFe = 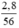 = 0,05 (mol)
= 0,05 (mol)
nH2 (1) = nCu = 0,05 mol ⇒ VH2(1) = 22,4 . 0,05 = 1,12 lít
nH2 (2) = 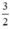 . nFe =
. nFe = 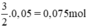 ⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
VH2 = VH2(1) + VH2(2) = 1,12 + 1,68 = 2,8(l)

a) Cho một mảnh kẽm vào ống nghiệm đựng dung dịch axit clohidric
Zn+HCl->ZnCl2+H2
=>Zn tan có khí thoát ra
b) Cho một luồng khí hidro qua bột đồng (II) oxit nung nóng
H2+CuO-to>Cu+H2O
=>chất rắn chuyển từ đen sang đỏ
c) Cho một mẩu kim loại Natri vào cốc nước
2Na+2H2O->2NaOH+H2
=>Na tan có khí thoát ra
d) Cho vào bát sứ một cục nhỏ vôi sống (CaO) rồi rót một ít nước vào vôi sống
CaO+H2O->Ca(OH)2
=> CaO tan , có nhiệt độ cao

Phương trình điều chế hiđro
CH4 + 2H2O -to, xt→ CO2 + 4H2
Phương trình loại khí oxi:
CH4 + 2O2 -to→ CO2 + 2H2O
Phương trình tống hợp amoniac:
N2 + 3H2 -450-500o, Fe, 200-300atm→ 2NH3

nFe= 11,2 : 56 = 0,2 (mol)
pthh : Fe + 2HCl --> FeCl2 + H2(phan ung the )
0,2 -----------------------> 0,2 (mol)
=> VH2 = 0,2 . 22,4 = 4,48 ( l)
pthh : CuO + H2 -t--> Cu +H2O
0,2---> 0,2 (mol)
=> mCu = 0,2 . 64 = 12,8 (mol)

1. Tính khối lượng chất tham gia và sản phẩm
* Các bước giải:
- Đổi số liệu đầu bài. Tính số mol của chất mà đầu bài cho.
- Lập phương trình hoá học.
- Dựa vào số mol chất đã biết để tính số mol chất cần tìm.
2. Tính thể tích khí tham gia và tạo thành
H2+Cl2->2HCl
\(n_{H_2}=67,2:22,4=3\left(mol\right)\)
Ta có: \(n_{H_2}=n_{Cl_2}=3\left(mol\right)\)
\(V_{Cl_2}=3.22,4=67,2l\)
\(n_{HCl}=2n_{Cl_2}=2.3=6\left(mol\right)\)
\(m_{HCl}=6.36,5=219g\)

Phương trình hóa học của phản ứng:
Fe + H2SO4 → FeSO4 + H2.
Zn + H2SO4 → ZnSO4 + H2.
Fe + 2HCl → FeCl2 + H2.
Zn + 2HCl → ZnCl2 + H2.
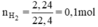
Theo phương trình (3) mFe cần dùng: 56.0,1 = 5,6g.
Theo phương trình (4) mZn cần dùng: 65.0,1 = 6,5g.
\(a)\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ b)\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ c)\ Fe + 2HCl \to FeCl_2 + H_2\)
a) : Phản ứng hóa hợp
b) : Phản ứng oxi hóa khử
c) : Phản ứng thế