Nhiệt phân khí metan ở nhiệt độ cao sau đó làm lạnh nhanh thu được hỗn hợp X gồm axetilen,
hiđro và metan dư. Tỉ khối của X so với H2 bằng 5. Hiệu suất phản ứng nhiệt phân là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: dhỗn hợp/H2 = 4,44 ⇒ Mhỗn hợp = 4,44.2 = 8,88
Gọi nCH4 ban đầu là là 1
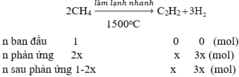
Tổng số mol khí sau phản ứng: 1 - 2x + x + 3x = 1 + 2x (mol)
MX = 2. 4,44 = 8,88
Áp dụng định luật bảo toàn khối lượng ta có:
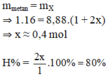

Đáp án C
Bảo toàn khối lượng: mCH4 ban đầu = mX = 0,08 × 5 × 2 = 0,8(g).
⇒ nCH4 ban đầu = 0,8 ÷ 16 = 0,05 mol || Lại có: nπ sinh ra = ∆n.
||⇒ nBr2 phản ứng tối đa = nπ sinh ra = 0,03 mol ⇒ mBr2 = 4,8(g)

Đáp án C
Bảo toàn khối lượng: mCH4 ban đầu = mX = 0,08 × 5 × 2 = 0,8(g).
⇒ nCH4 ban đầu = 0,8 ÷ 16 = 0,05 mol || Lại có: nπ sinh ra = ∆n.
||⇒ nBr2 phản ứng tối đa = nπ sinh ra = 0,03 mol ⇒ mBr2 = 4,8(g)

Đáp án B
Hướng dẫn Phương trình phản ứng:
2 C 2 H 4 → 1500 C 0 , l à m l ạ n h n h a n h C 2 H 2 + 3 H 2 B a n đ ầ u : 1 m o l P / ư : x s a u p / ư : 1 - x x 2 3 x 2
M - = 16 . ( 1 - x ) + 26 . x 2 . 2 . 3 x 2 1 - x + x 2 + 3 x 2
=> x = 0,6
=> Vậy hiệu suất chuyển hóa là 60%

Phương trình hóa học: ![]()
Lấy số mol CH4 là 1 mol
Sơ đồ phản ứng: 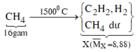
![]()
![]()
Theo (*) cứ 2 phân tử CH4 mất đi sẽ sinh ra 1 phân tử C2H2 và 3 phân tử H2
=> Số phân tử khí tăng = 1 + 3 – 2 = 2
=> Số phân tử khí tăng = Số phân tử khí CH4 mất đi.
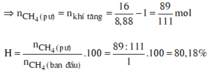
Đáp án B

Đáp án C
BTKL: nđ.Mđ=ns.Ms=>nđ.16=0,08.10=>nđ=0,05 mol
=>n tăng=0,08-0,05=0,03 mol
2CH4 → C2H2+3H2 tăng 2 mol
0,015 tăng 0,03
=>nBr2=2nC2H2=0,03 mol =>mBr2=4,8 gam

Đáp án C
Nhận thấy đốt cháy X tương đương đốt cháy metan
→ nCH4 = nO2 : 2 = 0,15 mol
Luôn có mCH4 = mX→ nX =
0
,
15
.
16
4
,
8
.
2
= 0,25 mol
nX - nCH4 = nCH4 pư → nCH4 pứ = 0,1 mol
Vậy H =
0
,
1
0
,
15
×100% = 66,67%.

Đáp án A
Nhìn vào đề bài nhận thấy tất cả các số liệu đề cho cũng như đáp án đều ở dạng số liệu tương đối. Do đó nhận thấy dấu hiệu của phương pháp tự chọn lượng chất. Ta có thể chọn cho số mol metan có ban đầu là 1 mol

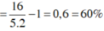

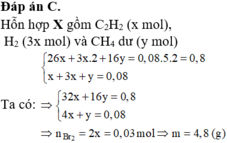

Gọi số mol CH4 ban đầu là 1 (mol), số mol phản ứng là a (mol)
PTHH: 2CH4--to, làm lạnh nhanh--> C2H2 + 3H2
Trc pư: 1 0 0
Pư: a--------------------------->0,5a--->1,5a
Sau pư: (1-a) 0,5a 1,5a
=> \(\Sigma n=\left(1-a\right)+0,5a+1,5a=1+a\left(mol\right)\)
\(m_X=m_{CH_4\left(bđ\right)}=1.16=16\left(g\right)\)
=> \(\overline{M}_X=\dfrac{16}{1+a}=5.2=10\)
=> a = 0,6 (mol)
=> \(H\%=\dfrac{0,6}{1}.100\%=60\%\)
gọi số CH4 ban đầu là a, CH4 sau pư là 2b
CH4->C2H2+3H2
a
2b---------b-------3b
mà MX=2.5=10 đvC
Δn =b +3b-2b=2b=n CH4pu
BTKL:
m CH4=mX
->16a=10nX
->nX=1,6a
Mặt khác: Δn =nX-n CH4=1,6a-a=0,6a
=>2b=0,6a
H=\(\dfrac{0,6a}{a}.100\)=60%