Cho 5,92 g hỗn hợp gồm Fe và Fe2O3 vào 500 ml dung dịch HCl xM sau phản ứng thu được 448 ml khí điều kiện tiêu chuẩn a) Tính x b) nếu cho 5,92 gam hỗn hợp trên tác dụng với khí Cl2 dư Tính khối lượng Cl2 phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nH2 = 0,672/22,4 = 0,03 (mol)
PTHH: Fe + 2HCl -> FeCl2 + H2
nFe = 0,03 (mol)
mFe = 0,03 . 56 = 1,68 (g)
mCu = 2,96 - 1,68 = 1,28 (g)
nCu = 1,28/64 = 0,02 (mol)
PTHH:
2Fe + 3Cl2 -> (t°) 2FeCl3
0,03 ---> 0,045
Cu + Cl2 -> (t°) CuCl2
0,02 ---> 0,02
nCl2 = 0,045 + 0,02 = 0,065 (mol)
VCl2 = 0,065 . 22,4 = 1,456 (l)

\(n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
a) \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
b) \(n_{Fe}=n_{H2}=n_{H2SO4}=0,1\left(mol\right)\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow m_{Al2O3}=15,8-5,6=10,2\left(g\right)\)
c) Ta có : \(n_{Al2O3}=\dfrac{10,2}{102}=0,1\left(mol\right)\Rightarrow n_{H2SO4}=3n_{Al2O3}=0,3\left(mol\right)\)
\(C_{MddH2SO4}=\dfrac{0,1+0,3}{0,2}=2M\)

a)Fe + 2HCl ->FeCl2 + H2\(\uparrow\)
0.01 0.01
FeS + 2HCl ->FeCl2 + H2S\(\uparrow\)
0.1 0.1
H2S + Pb(NO3)2->PbS \(\downarrow\) + 2HNO3
0.1 0.1
nPbS =2.39/239=0.1 mol , n (hỗn hợp khí) =2.464/22.4=0.11 mol
n(H2)+n(H2S)=0.11 ->n(H2)=0.01 mol
V(H2)=n * 22.4 = 0.01*22.4=0.224(l)
V(H2S)=n*22.4=0.1*22.4=2.24(l)
m(Fe)=n*M=0.01*56=0.56(g)
m(FeS)=n*M=0.1*88=8.8(g)

Sửa đề: 6,4 gam hh \(\rightarrow\) 6,45 gam hh
a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+27b=6,45\) (1)
Ta có: \(n_{H_2}=\dfrac{7,28}{22,4}=0,325\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,65\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{Mg}=0,1\left(mol\right)\\b=n_{Al}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1\cdot24}{6,4}\cdot100\%=37,5\%\\\%m_{Mg}=62,5\%\end{matrix}\right.\)
b) Ta thấy với 6,45 gam hh thì có 0,1 mol Mg và 0,15 mol Al
\(\Rightarrow\) Trong 12,9 gam hh thì chứa 0,2 mol Mg và 0,3 mol Al
Gọi \(n_{SO_2}=x\left(mol\right)\)
Bảo toàn electron: \(2\cdot0,2+3\cdot0,3=2x\) \(\Rightarrow x=n_{SO_2}=0,65\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,65\cdot22,4=14,56\left(l\right)\)
gọi số mol của Mg là x mol ; Al là y mol => 24x + 27y =6,4
n khí = 7,28/22,4=0,325 mol
bảo toàn e ta có
Mg + H2SO4 --> MgSO4 + H2
x x mol
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
y 3/2 y mol
=> x + 3/2y=0,325
=> x=11/120 mol ; y=7/45 mol
=> mMg11/120*24=2,2g => %mMg = 2,2*100/6,4=34,375%
=>%mAl=100-34,375=65,625%

Sửa đề: 3,785 (l) → 3,7185 (l)
a, \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
b, Ta có: \(n_{H_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
Theo PT: \(n_{Al}=\dfrac{2}{3}n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,1.27}{40}.100\%=6,75\%\\\%m_{Al_2O_3}=93,25\%\end{matrix}\right.\)
c, \(n_{Al_2O_3}=\dfrac{40.93,25\%}{102}=\dfrac{373}{1020}\left(mol\right)\)
Theo PT: \(n_{HCl}=3n_{Al}+6n_{Al_2O_3}=\dfrac{212}{85}\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{\dfrac{212}{85}}{2}=\dfrac{106}{85}\left(l\right)\approx1247,06\left(ml\right)\)
d, \(n_{AlCl_3}=n_{Al}+2n_{Al_2O_3}=\dfrac{212}{255}\left(mol\right)\)
\(\Rightarrow m_{AlCl_3}=\dfrac{212}{255}.133,5=\dfrac{9434}{85}\left(g\right)\)
e, \(C_{M_{AlCl_3}}=\dfrac{\dfrac{212}{255}}{\dfrac{106}{85}}=\dfrac{2}{3}\left(M\right)\)

Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{HCl}=2n_{H_2}=0,2\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,2}{0,1}=2\left(M\right)\)
\(n_{Fe}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow m_{Cu}=20-5,6=14,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{20}.100\%=28\%\\\%m_{Cu}=72\%\end{matrix}\right.\)

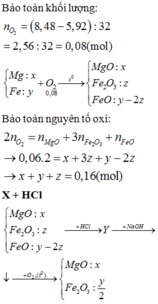
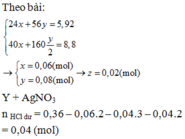
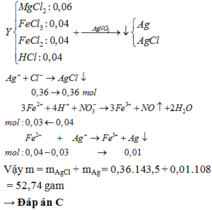

Fe+2HCl->FeCl2+H2
0,02-0,04--------------0,02
Fe2O3+6HCl->2Fecl3+3H2O
0,03-----0,18 mol
n H2=\(\dfrac{0,448}{22,4}\)=0,02 mol
=>m Fe=0,02.56=1,12g
=>m Fe2O3=4,8g=>n Fe2O3=\(\dfrac{4,8}{160}\)=0,03 mol
=>x=CMHCl=\(\dfrac{0,22}{0,5}\)=0,44M
b)
2Fe+3Cl2-to>2FeCl3
0,02---0,03
=>m Cl2=0,03.71=2,13g
Giúp mình vớiii