cho 5,4 gam kim loại nhôm vào dung dịch có chứa 7,3gam axit clohiddric
a)viết phương trình hóa học xảy ra
b)tìm khối lượng của các chất sau khi phản ứng kết thúc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a.PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(b.n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\\ n_{HCl}=\dfrac{m}{M}=\dfrac{3,65}{\left(1+35,5\right)}=0,1\left(mol\right)\)
Tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,1}{2}\Rightarrow Zn\) dư và dư \(m_{Zn}=n.M=0,2.65=13\left(g\right)\)
\(PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
1 2 1 1
0,05 0,1 0,05 0,05
\(m_{ZnCl_2}=n.M=0,05.\left(65+35,5.2\right)=6,8\left(g\right)\\ m_{H_2}=n.M=0,05.2=0,1\left(g\right).\)
a)\(PTHH:Zn+2HCl\xrightarrow[]{}ZnCl_2+H_2\)
b)\(n_{Zn}=\dfrac{13}{65}=0,2\left(m\right)\)
\(n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(m\right)\)
\(PTHH:Zn+2HCl\xrightarrow[]{}ZnCl_2+H_2\)
ta có tỉ lệ:\(\dfrac{0,2}{1}>\dfrac{0,1}{2}=>Zn\) dư
\(PTHH:Zn+2HCl\xrightarrow[]{}ZnCl_2+H_2\)
tỉ lệ :1 2 1 2
số mol :0,05 0,1 0,05 0,05
\(m_{ZnCl_2}=0,05.136=6,8\left(g\right)\)
\(m_{H_2}=0,05.2=0,1\left(g\right)\)

a, \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b, \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{H_2}=\dfrac{3}{2}n_{Al}=0,6\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,6.98}{25\%}=235,2\left(g\right)\)
c, \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,2\left(mol\right)\)
\(\Rightarrow C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,2.342}{10,8+235,2-0,6.2}.100\%\approx27,94\%\)

\(n_{H_2}=\dfrac{5,6}{22,4}=0,25(mol)\\ a,PTHH:Fe+2HCl\to FeCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\)
\(b,\) Đặt \(n_{Fe}=x(mol);n_{Al}=y(mol)\)
\(\Rightarrow 56x+27y=8,3(1)\)
Theo PTHH: \(x+1,5y=0,25(2)\)
\((1)(2)\Rightarrow x=y=0,1(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,1.56}{8,3}.100\%=67,47\%\\ \%_{Al}=100\%-67,47\%=32,53\%\)

a) 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b) số mol Al: n(Al)=0,2 mol
Khối lượng H2SO4: 30g
Số mol H2SO4: n(H2SO4)=15/49 ~~ 0,306 mol
Do n(Al)/2 < n(H2SO4)/3
--> Al hết, H2SO4 dư
Các chất sau phản ứng là: 0,1 mol Al2(SO4)3, 0,3 mol H2 và 0,006 mol H2SO4 dư
Từ đó bạn tính khối lượng từng cái là xong.

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\
n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\
pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(LTL:\dfrac{0,2}{1}< \dfrac{0,25}{1}\)
=> H2SO4 dư
\(n_{H_2}=n_{H_2SO_4\left(p\text{ư}\right)}=n_{Fe}=0,2\left(mol\right)\\
V_{H_2}=0,2.22,4=4,48l\\
m_{H_2SO_4\left(d\right)}=\left(0,25-0,2\right).98=4,9g\)

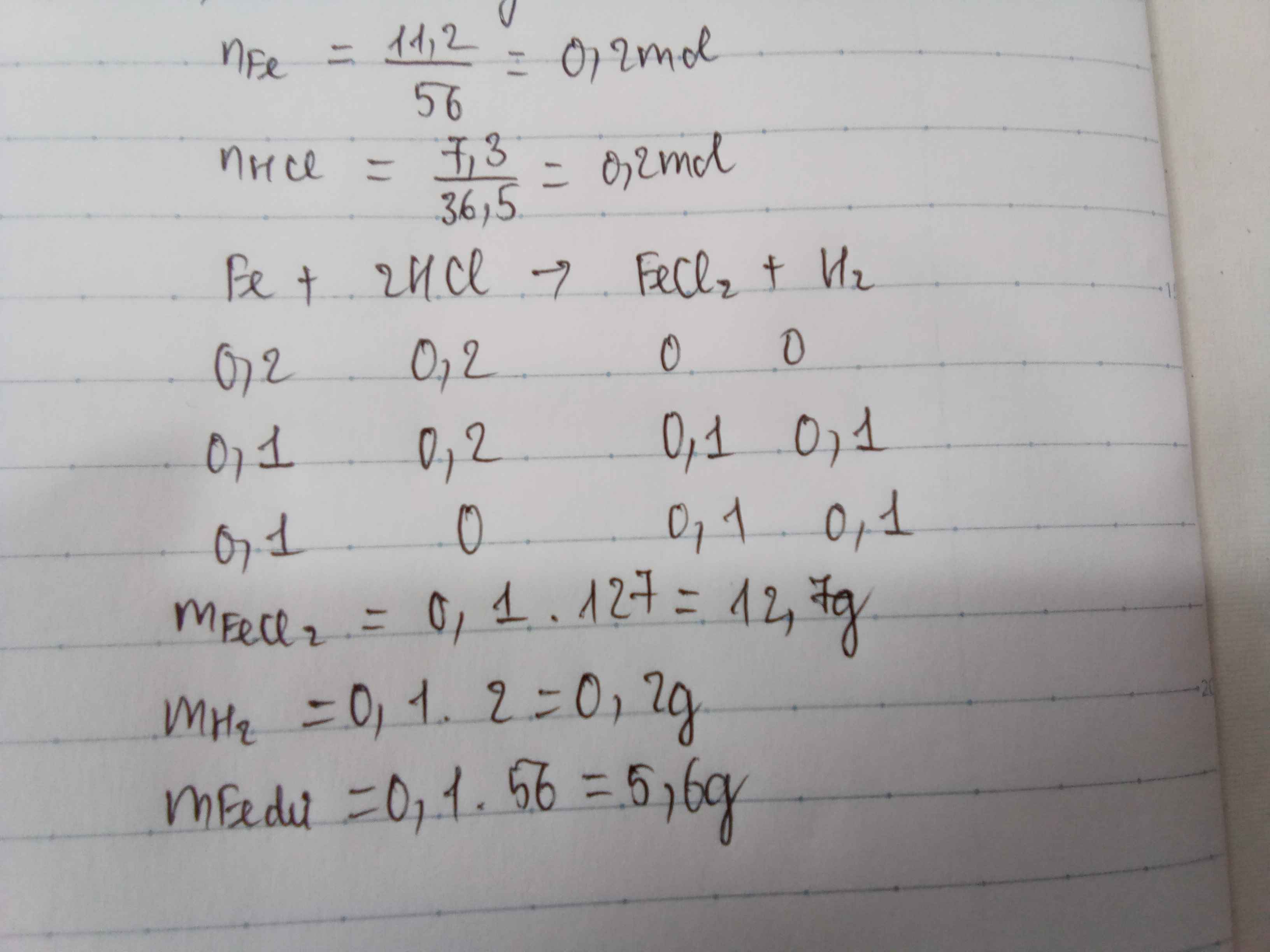


\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(n_{HCl}=\dfrac{7,3}{36,5}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\dfrac{0,2}{2}\) > \(\dfrac{0,2}{6}\) ( mol )
1/15 0,2 1/15 0,1 ( mol )
\(m_{AlCl_3}=\dfrac{1}{15}.13,5=8,9g\)
\(m_{H_2}=0,1.2=0,2g\)
\(m_{Al\left(dư\right)}=\left(0,2-\dfrac{1}{15}\right).27=3,6g\)