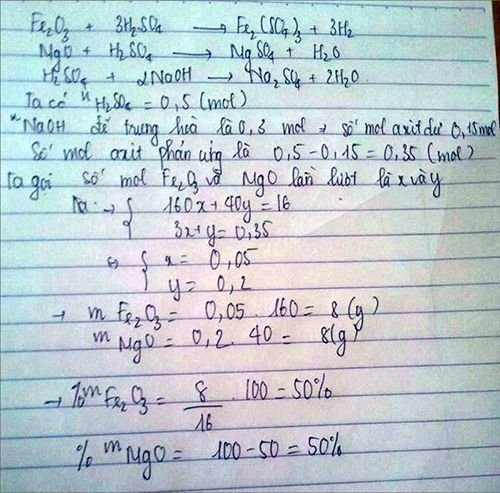Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Fe2O3 + 6HCl \(\rightarrow\)2FeCl3 + 3H2O (1)
MgO + 2HCl \(\rightarrow\)MgCl2 + H2O (2)
Ca(OH)2 + 2HCl \(\rightarrow\)CaCl2 + 2H2O (3)
nCa(OH)2=\(\dfrac{50.14,8\%}{74}=0,1\left(mol\right)\)
Theo PTHH 3 ta có:
nCa(OH)2=nCaCl2=0,1(mol)
2nCa(OH)2=nHCl=0,2(mol)
mCaCl2=111.0,1=11,1(g)
mmuối của Mg,Fe=46,35-11,1=35,25(g)
Đặt nFe2O3=a
nMgO=b
Ta có:
\(\left\{{}\begin{matrix}160a+40b=16\\325a+95b=35,25\end{matrix}\right.\)
=>a=0,05;b=0,2
mFe2O3=160.0,05=8(g)
%mFe2O3=\(\dfrac{8}{16}.100\%=50\%\)
%mMgO=100-50=50%
Từ 1 ta có:
6nFe2O3=nHCl(1)=0,3(mol)
2nMgO=nHCl=0,2(mol)
=>\(\sum\)nHCl=0,3+0,2+0,2=0,7(mol)
CM dd HCl=\(\dfrac{0,7}{0,3}=\dfrac{7}{3}M\)

Đặt \(\left\{{}\begin{matrix}n_{Al_2O_3}=a\left(mol\right)\\n_{MgO}=b\left(mol\right)\\n_{Fe_2O_3}=c\left(mol\right)\end{matrix}\right.\) \(\Rightarrow102a+40b+160c=2,22\)
\(Al_2O_3,MgO\) không bị khử bởi \(CO\)
\(PTHH:Fe_2O_3+3CO\underrightarrow{t^o}2Fe+3CO_2\)
\(\left(mol\right)\) \(c\) \(2c\)
\(\Rightarrow102a+40b+56.2c=1,98\)
\(PTHH:Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(\left(mol\right)\) \(a\) \(6a\)
\(PTHH:MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(\left(mol\right)\) \(b\) \(2b\)
\(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\left(mol\right)\) \(2c\) \(4c\)
\(\Rightarrow6a+2b+4c=0,1\)
Từ đó: \(\left\{{}\begin{matrix}a=0,01\left(mol\right)\\b=0,01\left(mol\right)\\c=0,005\left(mol\right)\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}\%m_{Al_2O_3}=45,95\left(\%\right)\\\%m_{MgO}=18,02\left(\%\right)\\\%m_{Fe_2O_3}=36,03\left(\%\right)\end{matrix}\right.\)
3. Đặt nAl2O3= x, nMgO=y, nFe2O3 = z
PTHH:
Fe2O3 + 3CO-----> 2Fe + 3CO2
Al2O3 + 6HCl ------> 2AlCl3 + 3H2O
MgO + 2HCl --------> MgCl2 + H2O
Fe + 2HCl -------> FeCl2 + H2
Ta có khối lượng của hỗn hợp X : \(102x+40y+160z=2,22\) (1)
Chất rắn Y gồm Fe, MgO và Al2O3
=> \(56.2z+102x+40y=1,98\) (2)
Theo PT ta có : \(n_{HCl}=6x+2y+2z.2=0.1.1\) (3)
Từ (1), (2), (3) => x=0,01 ; y=0,01, z= 0,005
=> \(\%m_{Al_2O_3}=\dfrac{0,01.102}{2,22}.100=45,95\%\)
\(\%m_{MgO}=\dfrac{0,01.102}{2,22}.100=18,01\%\)
=>\(\%m_{Fe_2O_3}=\dfrac{0,005.160}{2,22}.100=36,04\%\)

\(\text{nHCl = VHCl. CM = 1.1 = 1 (mol)}\)
Đặt số mol của MgO và Fe2O3 lần lượt là x và y (mol)
\(\text{PTHH: MgO + 2HCl ---> MgCl2 + H2O (1)}\)
................x ---> 2x (mol)
\(\text{Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O (2)}\)
y ----> 6y (mol)
dd sau phản ứng gồm MgCl2, FeCl3 và HCl dư. Trung hòa axit HCl dư bằng NaOH
mNaOH = mdd NaOH. C% : 100% = 100.24%:100% = 24 (g)
=> nNaOH = mNaOH : M NaOH = 24 : 40 = 0,6 (mol)
HCl + NaOH ---> NaCl + H2O (3)
0,6 <--0,6 (mol)
Theo PTHH (3): nHCl = nNaOH = 0,6 (mol)
=> nHCl (1)+(2) = nHCl bđ - nHCl (3) = 1 - 0,6 = 0,4 (mol)
Ta có hệ phương trình:
\(\left\{{}\begin{matrix}\sum m_{hh}=40x+160y=32\\\sum n_{HCL}\left(1\right)+\left(2\right)=2x+6y=0,4\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=-1,6\\y=0,6\end{matrix}\right.\Rightarrow Sai\)

1. Fe+2HCl-> FeCl2 + H2 (1)
CuO + 2HCl -> CuCl2 + H2O(2)
a.nH2=0,02(mol)=>nFe=0,02(mol)=> mFe=1,12(g)
=> nHCl(1)=0,04(mol)
nHCl dùng=\(\dfrac{15\cdot14,6}{100}=2,19\left(g\right)\)
=> nHCl=0,06(mol)
=>nHCl(2)=0,02(mol)=> nCuO=0,01(mol)
=> mCuO=0,8(g)
b. mddA=1,12+0,8+15-0,02*2=16,88(g)
mFeCl2=0,02*127=2,54(g)
mCuCl2=0,01*135=1,35(g)
C% FeCl2=\(\dfrac{2,54\cdot100}{16,88}=15,047\%\)
C% CuCl2=\(\dfrac{1,35\cdot100}{16,88}=7,9976\%\)