Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\Delta_rH^{^{ }o}_{298}=3\cdot436+945-2\left(3\cdot386\right)=-63kJ\cdot mol^{-1}\)
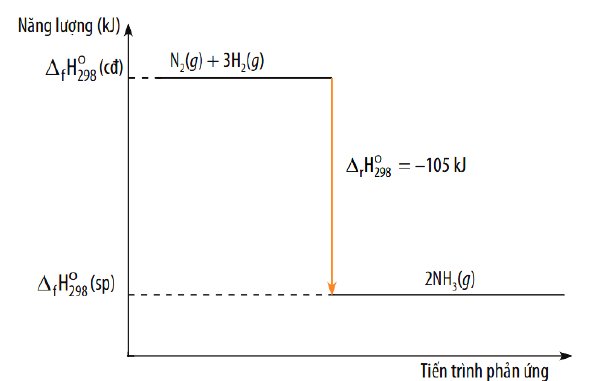
Sơ đồ:

\(\Delta_rH^{^o}_{298}=945+494-2\cdot607=+225kJ\\ \Rightarrow D\)
Bạn ơi, bạn có biết gì về Eb không vậy? Mình tính Eb(cđ) - Eb(sp) mà? Công thức đó đâu ra vậy?

A. Sai vì đó là nhiệt tạo thành của 2 mol HCl
B. Đúng vì (*) là phản ứng tỏa nhiệt nên enthalpy mang giá trị âm
C. Đúng vì nhiệt tạo thành tỉ lệ với số mol chất tạo thành, đây là phản ứng tỏa nhiệt nên mang giá trị âm
D. Sai vì phản ứng (*) ứng với 2 mol
=> Đáp án B, C đúng

∆r\(H^o_{298}\) = EH-H + EF-F – 2.FH-F
∆r\(H^o_{298}\) = 436 + 159 – 2.565 = -535 kJ

a)
- Xét phản ứng: F2(g) + H2(g) → 2HF (g)
+ Ta có: ∆rH0298 = Eb(F2) + Eb(H2) – 2xEb(HF) = 159 + 436 – 2x565 = -535 (kJ/mol)
- Xét phản ứng: O2(g) + 2H2(g) → 2H2O(g)
+ Ta có: ∆rH0298 = Eb(O2) + 2xEb(H2) – 2x2xEb(OH) = 142 + 2x436 – 2x2x464 = -842 (kJ/mol)
b)
Giá trị biến thiên enthalpy của phản ứng (2) âm hơn giá trị biến thiên enthalpy của phản ứng (1)
=> Phản ứng oxi hóa – khử (2) diễn ra thuận lợi hơn
a) Phương trình F2(g) + H2(g) → 2HF(g)
Δ𝑟𝐻0298 = -535 kJ
Phương trình: O2(g) + 2H2(g) → 2H2O (g)
Δ𝑟𝐻0298 = -842 kJ
b ) Phản ứng của oxygen thuận lợi hơn

\(\Delta_rH^o_{298}=2\left(-825,5\right)+8\left(-296,8\right)-4\left(-177,9\right)\\ \Delta_rH^o_{298}=-3313,8\left(kJ\right)\)

\(a.E_r=839,0+2\cdot418,4+2\cdot432,0=2539,8kJ\\ b.E_p=343,3+6\cdot418,4=2853,7kJ\\ c.\Delta_rH^{^{ }0}=2539,8-3197=-313,9kJ\cdot mol^{-1}\\ \Delta H< 0:pư.thu.nhiệt\)
\(a.E_{reactants}=839,0+2\cdot432,0=1703kJ\\ b.E_{products}=343,3+6\cdot432,0=2935,3kJ\\ c.\Delta_rH^{^o}_{298}=E_r-E_p=1703-2935,3=1232,3kJ\cdot mol^{^{ }-1}.\)
\(\Delta H< 0\) => Phản ứng (1) thu nhiệt

