Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Tốc độ phản ứng tăng lên (tăng diện tích bề mặt).
b) Tốc độ phản ứng giảm xuống (giảm nồng độ chất phản ứng).
c) Tốc độ phản ứng tăng.
d) Tốc độ phản ứng không thay đổi.

Chọn C
Khối lượng HCl có trong dung dịch ở ống (1) là 3.18% = 0,54 gam.
Khối lượng HCl có trong dung dịch ở ống (2) là 9.6% = 0,54 gam.
C sai vì thể tích khí H2 (đo cùng điều kiện) thu được ở hai ống là như nhau.

Thêm một lượng dung dịch HCl bốc khói vào dung dịch HCl 2M làm tăng nồng độ chất phản ứng HCl → tốc độ phản ứng tăng
Đun nóng hỗn hợp phản ứng, tăng nhiệt độ làm tăng tốc độ phản ứng
Tăng thể tích dung dịch lên gấp đôi, nồng độ không đổi → tốc độ phản ứng không ảnh hưởng
Thay CaCO3 dạng hạt bằng CaCO3 dạng bột → tăng diện tích tiếp xúc tăng tốc độ phản ứng.
Tăng áp suất của bình phản ứng, vì phản ứng không có sự tham gia của chất khí→tăng áp suất không ảnh hưởng đến tốc độ
Vậy có 3 yếu tố làm tăng tốc độ phản ứng. Đáp án B.

Đáp án A
Dạng bột diện tiếp xúc lớn hơn dạng viên, do đó tốc độ phản ứng của kẽm dạng bột lớn hơn kẽm dạng viên.
Nồng độ dung dịch H2SO4 giảm từ 4M xuống 2M, do đó tốc độ phản ứng giảm.
Nhiệt độ thường khoảng 25 độ C do đó khi thực hiện phản ứng ở 10 độ C tốc độ phản ứng sẽ giảm.
Nồng độ dung dịch H2SO4 không đổi, do đó tốc độ phản ứng không đổi.

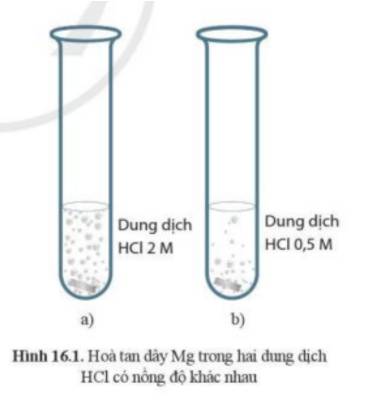
- Ở ống nghiệm (a) có hiện tượng sủi bọt khí nhiều hơn
=> Phản ứng ở ống nghiệm (a) xảy ra mãnh liệt hơn
=> Dây Mg ở ống nghiệm (a) sẽ bị tan hết trước
Mg + 2HCl → MgCl2 + H2↑

Các yếu tố làm tăng tốc độ phản ứng là: nhiệt độ (tăng thì tđpu tăng), áp suất (tăng thì tốc độ
phản ứng có chất khí tăng), S tiếp xúc (tăng thì tốc độ phản ứng tăng), nồng độ (tăng thì tốc độ phản ứng
tăng), xúc tác (luôn tăng)
(a) Có làm tăng tốc độ vì tăng diện tích tiếp xúc của oxi với Cu (ở ngoài không khí còn nhiều khí khác
chiếm chỗ)
(b) Đúng do làm tăng diện tích tiếp xúc giữa Zn và axit
(c) Có làm tăng vì phản ứng có chất khí, tốc độ phản ứng tăng khi tăng áp suất
(d) Không làm thay đổi vì nồng độ của HCl không thay đổi nên tốc độ phản ứng không tăng
Có 3 thay đổi làm tăng tốc độ phản ứng. Đáp án C

Chọn B
Zn bột có tổng diện tích bề mặt tiếp xúc với chất phản ứng (HCl) lớn hơn so với kẽm miếng có cùng khối lượng, nên có tốc độ phản ứng lớn hơn.

\(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=5,6\left(g\right)\)
\(\Rightarrow m_{Fe_2O_3}=16\left(g\right)\)
\(\Rightarrow n_{Fe}=2n_{Fe_2O_3}=0,2\left(mol\right)=n_{FeCl_3}\)
Lại có : \(n_{HCl}=2n_{H_2}+3n_{FeCl_3}=0,8\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=292\left(g\right)\)
\(\Rightarrow V=\dfrac{2920}{11}\left(ml\right)=\dfrac{73}{275}\left(l\right)\)
\(\Rightarrow C_{MFeCl_3}=\dfrac{0,2}{\dfrac{73}{275}}=\dfrac{55}{73}\left(M\right)\)


Đáp án D.
Nồng độ là một trong những yếu tố giúp tăng tốc độ phản ứng.
(Ở một nhiệt độ xác định. Khi nồng độ của các chất tham gia tăng thì tốc độ phản ứng cũng tăng.)