Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có: nNaOH = 0,15 mol; nBa(OH)2 = 0,05 mol
Dung dịch Y chứa 0,15 mol Na+, 0,05 mol Ba2+, u mol AlO2- và v mol OH- dư
Định luật bảo toàn điện tích ta có u + v = 0,15 + 0,05.2 = 0,25 (1)
Ta có: nHCl = 0,32 mol và nH2SO4 = 0,04 mol→ nH+ = 0,4 mol; nSO4(2-) = 0,04 mol
→ nBaSO4 = 0,04 mol
Ta có: mkết tủa = 21,02 gam → nAl(OH)3 = 0,15 mol
Nếu Al(OH)3 chưa bị hòa tan thì nH+ = 0,4 = v + 0,15 (2)
Nếu Al(OH)3 đã bị hòa tan thì nH+ = 0,4 = v + 4u - 3.0,15 (3)
Giải hệ (1) và (2) ra vô nghiệm
Giải hệ (1) và (3) ra u = 0,2 và v = 0,05
Vậy Y gồm Na+ 0,15 mol; 0,05 mol Ba2+; 0,2 mol AlO2- và OH- dư (0,05 mol)
V lít dung dịch Z gồm 0,64V mol HCl và 0,08V mol H2SO4
→ nH+ = 0,8V mol và nSO4(2-) = 0,08 V mol
Khi Al(OH)3 max thì 0,8V = u+ v suy ra V = 0,3125
Suy ra nBaSO4 = 0,025 mol → mkết tủa = 21,425 gam
Khi BaSO4 max thì 0,08V = 0,05 suy ra V = 0,625
Suy ra nH+ = 0,8V = v + 4u-3.nAl(OH)3 → nAl(OH)3 = 7/60 mol → mkết tủa = 20,75 gam
Vậy mkết tủa max = 21,425 gam

Chọn đáp án B.
Nhận thấy nOH-: nAl3+ = 1,5 => Tính kết tủa theo OH- => mAl(OH)3 = 78×0,03/3 = 0,78

Đáp án B
Ta có : n A l 2 S O 4 3 = 0 , 5 m o l
Cho Ba tác dụng với Al2(SO4)3 tức là cho Ba tác dụng với H2O tạo ra Ba(OH)2 sau đó chất này tan.
Gọi số mol Ba là x. Ta có số mol kết tủa BaSO4 tạo ra là 0,15, số mol H2 là x mol.
Ta có: ![]()
Áp dụng bảo toàn khối lượng, khối lượng dung dịch giảm là:
![]()
Giải được: x = 0,16.
![]()
Vậy khi sục CO2 dư vào X thì kết tủa tạo ra là Al(OH)3 0,02 mol (không thể có BaCO3).
m = 1 , 56 g a m

Định hướng tư duy giải
Tư duy điền số điện tích cho X
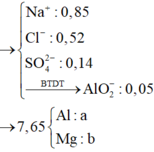
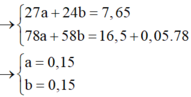
Nhận thấy kết tủa max khi BaSO4 max
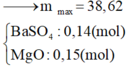


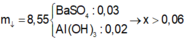

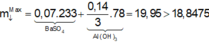
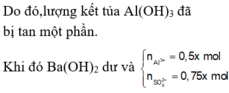
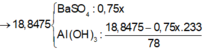
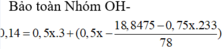
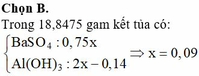





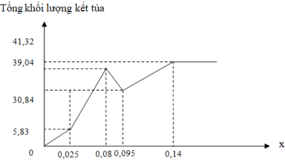
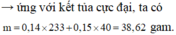
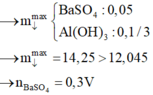
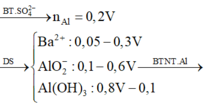
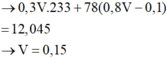

Đáp án B