Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cho hỗn hợp các chất khí đi từ từ qua dung dịch NaOH lấy dư. Các khí C02, S02, Cl2, HCl phản ứng với NaOH, tạo thành các muối tan trong dung dịch. Khí nitơ không phản ứng với NaOH sẽ thoát ra ngoài. Cho khí nitơ có lẫn một ít hơi nước đi qua dung dịch H2S04 đậm đặc, hơi nước sẽ bị H2S04 hấp thụ, ta thu được khí nitơ tinh khiết.
Các phương trình hoá học :
C02 + 2NaOH →→ Na2C03 + H20
S02 + 2NaOH →→ Na2S03 + H20
Cl2 + 2NaOH →→ NaCl + NaClO + H20
HCl + NaOH →→ NaCl + H20

1. Phương trình hoá học của các phản ứng :
2 N H 3 + 3CuO → t ° N 2 + 3Cu + 3 H 2 O (1)
Chất rắn A thu được sau phản ứng gồm Cu và CuO còn dư. Chỉ có CuO phản ứng với dung dịch HCl :
CuO + 2HCl → C u C l 2 + H 2 O (2)
2. Số mol HCl phản ứng với CuO : n H C l = 0,02.1 = 0,02 (mol).
Theo (2), số mol CuO dư : n C u O = n H C l / 2 = 0,01 (mol).
Số mol CuO tham gia phản ứng (1) = số mol CuO ban đầu - số mol CuO dư = 0,03 (mol).
Theo (1) n N H 3 = 2 n C u O /3 = 0,02 (mol) và nN2 = n C u O /3 = 0,01 (mol).
Thể tích khí nitơ tạo thành : 0,01. 22,4 = 0,224 (lít) hay 224 ml.

CH2=CH2 + Br2 → CH2Br-CH2Br
CH≡CH + Br2 → CHBr2-CHBr2
CH≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓vàng + 2NH4NO3
Khí không bị hấp thụ (hay không có phản ứng) là khí propan (C3H8)

Chọn đáp án B.
CO2, SO2 đều là oxit axit nên phản ứng dễ dàng với các dd kiềm, nên có thể dùng Ca(OH)2, NaOH để loại bỏ 2 khí này. Nếu dùng dung dịch KMnO4 hoặc nước Br2 thì không loại bỏ được khí CO2, và còn làm mất C2H4

1. Phương trình hoá học của các phản ứng:
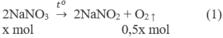
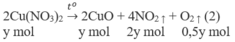
2. Đặt X và y là số mol của N a N O 3 và C u ( N O 3 ) 2 trong hỗn hợp X. Theo các phản ứng (1) và (2) số mol NO2 thu được là 2y mol và tổng số mol oxi là (0,5x + 0,5y) mol.
Biết khối lượng mol của hai chất N a N O 3 và Cu(NO3)2 tương ứng là 85 và 188 (g/mol), ta có hệ phương trình :
85x + 188y = 27,3 (a)
0,5x + 2y + 0,5y = 0,3 (b)
Giải hệ phương trình (a), (b) được : x = y = 0,1.
Phần trăm khối lượng của mỗi muối trong hỗn hợp X :
![]()
% m C u ( N O 3 ) 2 = 100% - 31,1% = 68,9%

Phương trình điều chế hiđro
CH4 + 2H2O -to, xt→ CO2 + 4H2
Phương trình loại khí oxi:
CH4 + 2O2 -to→ CO2 + 2H2O
Phương trình tống hợp amoniac:
N2 + 3H2 -450-500o, Fe, 200-300atm→ 2NH3

N2+3H2->2NH3
Vì tỉ lệ thể tích= tỉ lệ số mol( các khí đo cùng điều kiện) nên ta có
N2+3H2-> 2 NH3
4. 14
Ta có tỉ lệ 4/1< 14/3 => H2 dư, hiệu suất pứ tính theo N2
N2+3H2 ->2NH3
4. 14. ( Ban đầu)
x. 3x. 2x. (Pứ)
4-x. 14-3x. 2x. (Sau pứ)
Thể tích khí thu được sau pứ V=16lit
4-x +14-3x+2x=16
=> x=1
Hiệu suất pứ H=1.100%/4 = 25%

N 2 (k) + 3 H 2 (k) ↔ 2 N H 3 (k)
Số mol khí ban đầu :
2 7 0
Số mol khí đã phản ứng :
x 3x
Số mol khí lúc cần bằng :
2 - x 7 - 3x 2x
Tổng số mol khí lúc cân bằng : (2 - x) + (7 - 3x) + 2x = 9 - 2x
Theo đề bài : 9 - 2x = 8,2 ⇔ x = 0,4
1. Phần trăm sô mol nitơ đã phản ứng: 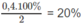
2. Thể tích (đktc) khí amoniac được tạo thành: 2.0,4.22,4 = 17,9 (lít).

Chọn đáp án B
Cho hỗn hợp khí phản ứng với CuO dư, nung nóng.
Sau phản ứng chỉ thu được C O 2 tinh khiết, do
CuO + CO → t 0 Cu + C O 2


Cho hỗn hợp các chất khí đi từ từ qua dung dịch NaOH lấy dư. Các khí C O 2 , S O 2 , C l 2 , HCl phản ứng với NaOH, tạo thành các muối tan trong dung dịch. Khí nitơ không phản ứng với NaOH sẽ thoát ra ngoài. Cho khí nitơ có lẫn một ít hơi nước đi qua dung dịch H 2 S O 4 đậm đặc, hơi nước sẽ bị H 2 S O 4 hấp thụ, ta thu được khí nitơ tinh khiết.
Các phương trình hoá học :