Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Zn + H2SO4 (loãng) ---> ZnSO4 + H2
0,2<--------------------------------------0,2
Zn + 2H2SO4 (đặc) ---> ZnSO4 + SO2↑ + 2H2O
0,2--->0,4------------------------------->0,2
Cu + 2H2SO4 ---> CuSO4 + SO2↑ + 2H2O
0,2<--0,4<------------------------0,2
b, \(\left\{{}\begin{matrix}m_{Zn}=0,2.65=13\left(g\right)\\m_{Cu}=0,2.64=12,8\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{13}{13+12,8}.100\%=50,4\%\\\%m_{Cu}=100\%-50,4\%=49,6\%\end{matrix}\right.\)
c, PTHH:
SO3 + H2O ---> H2SO4
0,4<---------------0,4
2SO2 + O2 --to, V2O5--> 2SO3
0,4<---------------------------0,4
4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
0,2<--------------------------------------0,4
=> \(m_{FeS_2}=\dfrac{0,2.120}{100\%-20\%}=30\left(g\right)\)

nH2=4,48/22,4=0,2 mol
Fe +2HCl -->FeCl2+H2
0,2 0,2 mol
=>mFe=0,2*56=11,2 g
nSO2=10,08/22,4=0,45 mol
gọi số mol của Cu là a mol
bảo toàn e ta có
Cu\(^0\)-->Cu\(^{+2}\)+2e
a 2a S\(^{+6}\) + 2e -->S\(^{+4}\)
Fe\(^0\)--> Fe\(^{+3}\)+3e 0,45 0,9
0,2 0,6
=>a=0,15=>mCu=0,15*64=9,6 g
=>mhh=9,6+11,2=20,8g
=>%Cu=9,6*100/20,8=46,15%

Đáp án A
Gọi số mol các kim loại là Al: a mol; Fe: b mol.
Ta có:
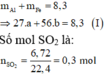
Sơ đồ phản ứng:
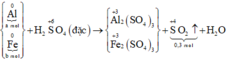
Các quá trình nhường, nhận electron:


\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
0,2 0,3
\(\rightarrow m_{Al}=0,2.27=5,4\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{5,4}{13,4}=40,3\%\\\%m_{CuO}=100\%-40,3\%=59,7\%\end{matrix}\right.\\ n_{CuO}=\dfrac{13,4-5,4}{80}=0,1\left(mol\right)\)
PTHH:
2Al + 6H2SO4 ---> Al2(SO4)3 + 3SO2 + 6H2O
0,2 0,6 0,1 0,3
CuO + H2SO4 ---> CuSO4 + H2O
0,1 0,1 0,1
\(V_{SO_2}=0,3.22,4=6,72\left(l\right)\)
Mặc định C% H2SO4 là 98% nhé
\(m_{ddH_2SO_4}=\dfrac{98.\left(0,1+0,6\right)}{98\%}=70\left(g\right)\\ m_{dd\left(sau.pư\right)}=70-64.0,3+13,4=64,2\left(g\right)\)
\(\rightarrow\left\{{}\begin{matrix}C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1.342}{64,2}=53,27\%\\C\%_{CuSO_4}=\dfrac{0,1.160}{64,2}=24,92\%\end{matrix}\right.\)
a)\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(m_{Al}=0,2\cdot27=5,4g\)
\(\%m_{Al}=\dfrac{5,4}{13,4}\cdot1005=40,3\%\Rightarrow\%m_{CuO}=59,7\%\)
Câu b có thiếu dữ kiện đề bài không nhỉ

`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 3SO_2 \uparrow + 6H_2 O`
`0,05` `0,15` `0,025` `(mol)`
`Cu + 2H_2 SO_[4(đ,n)] -> CuSO_4 + SO_2 \uparrow + 2H_2 O`
`0,225` `0,45` `0,225` `(mol)`
`n_[SO_2]=[6,72]/[22,4]=0,3(mol)`
Gọi `n_[Fe]=x` ; `n_[Cu]=y`
`=>` $\begin{cases} \dfrac{3}{2}x+y=0,3\\56x+64y=17,2 \end{cases}$
`<=>` $\begin{cases}x=0,05\\y=0,225 \end{cases}$
`@m_[Fe_2(SO_4)_3]=0,025.400=10(g)`
`@m_[CuSO_4]=0,225.160=36(g)`
`@m_[dd H_2 SO_4]=[(0,15+0,45).98]/80 .100=73,5(g)`
Sửa đề: 80% ---> 98% (80% chưa đặc nên không giải phóng SO2 được)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(\rightarrow56a+64b=17,2\left(1\right)\)
PTHH:
\(2Fe+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
a------>3a------------------->0,5a--------------->1,5a
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
b----->2b------------------->b------------->b
\(\rightarrow1,5a+b=\dfrac{6,72}{22,4}=0,3\left(2\right)\)
Từ \(\left(1\right)\left(2\right)\rightarrow\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,225\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe_2\left(SO_4\right)_3}=0,5.0,05.400=10\left(g\right)\\m_{CuSO_4}=0,225.160=36\left(g\right)\\m_{ddH_2SO_4}=\dfrac{\left(0,05.3+0,225.2\right).98}{98\%}=60\left(g\right)\end{matrix}\right.\)

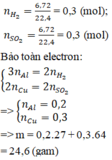

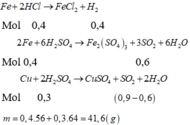



Đáp án C