Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH Giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)
Đáp án D

Đáp án D
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)

Đáp án D
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2
=> X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol)
=> nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)

Đáp án B
Đặt nBa = a, nBaO = 2a và nBa(OH)2 = 3a
⇒ nH2 = nBa = a ⇒ ∑nBa(OH)2 = a + 2a 3a = 6a = 6V/22.4
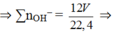
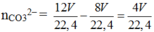
⇒ nBaCO3 = (4V/22,4) × 197 = 98,5 Û V = 2,8.
⇒ nBa = 2,8/22,4 = 0,125 mol ⇒ nBaO = 0,25, nBa(OH)2 = 0,375.
⇒ m = 0,125×137 + 0,25×153 + 0,375×171 = 119,5 gam

Đáp án B
Đặt nBa = a, nBaO = 2a và nBa(OH)2 = 3a
⇒ nH2 = nBa = a ⇒ ∑nBa(OH)2 = a + 2a 3a = 6a = 6 V 22 , 4
⇒ ∑nOH– = 12 V 22 , 4 ⇒ nCO32– = 12 V 22 , 4 - 8 V 22 , 4 = 4 V 22 , 4 .
⇒ nBaCO3 = 4 V 22 , 4 × 197 = 98,5 ⇔ V = 2,8.
⇒ nBa = 2 , 8 22 , 4 = 0,125 mol ⇒ nBaO = 0,25, nBa(OH)2 = 0,375.
⇒ m = 0,125×137 + 0,25×153 + 0,375×171 = 119,5 gam

Đáp án B
Đặt nBa = a, nBaO = 2a và nBa(OH)2 = 3a
⇒ nH2 = nBa = a
⇒ ∑nBa(OH)2 = a + 2a 3a = 6a = 6 V 22 , 4
⇒ ∑nOH– = 12 V 22 , 4 ⇒ nCO32– = 4 V 22 , 4 .
⇒ nBaCO3 = 4 V 22 , 4 × 197 = 98,5
Û V = 2,8.
⇒ nBa = 2 , 8 22 , 4 = 0,125 mol
⇒ nBaO = 0,25, nBa(OH)2 = 0,375.
⇒ m = 0,125×137 + 0,25×153 + 0,375×171 = 119,5 gam

Đáp án C
nH2 = 0,15 mol ; nAl(OH)3 = 0,5 mol
- Hỗn hợp rắn X gồm: Fe, Al2O3 (x mol) và Al dư (y mol)
PTHH:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
CO2 + Na[Al(OH)4] → Al(OH)3 + NaHCO3
nH2 = 0,15 mol → y = 0,1 mol
Áp dụng ĐLBT nguyên tố với Al: 2x + y = 0,5 → x = 0,2 mol
Áp dụng ĐLBT nguyên tố với O: nO(Fe3O4) = nO(Al2O3) = 0,2.3=0,6 mol
⇒ nFe3O4 = 0,15mol
Áp dụng nguyên tố với Fe: nFe = 3nF3O4 = 3.0,15 = 0,45 mol
Áp dụng khối lượng: m = 0,45.56 + 0,2.102 + 0,1.27 = 48,3 gam


Giải thích:
Gọi nAl = a mol => nBa = a mol
Ba + H2O → Ba(OH)2 + H2
a → a
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2
a → 0,5a → 0,5a → 1,5a
=> dung dịch Y gồm Ba(AlO2)2 (0,5a mol) và Ba(OH)2 dư (0,5a mol)
Sục V lít CO2 (hay 2,5a mol CO2) vào Y
2CO2 + Ba(AlO2)2 + 4H2O → 2Al(OH)3 + Ba(HCO3)2
a ← 0,5a → a
2CO2 + Ba(OH)2 → Ba(HCO3)2
a ← 0,5a → 0,5a
=> kết tủa thu được chỉ là Al(OH)3 => mkết tủa = 78a = 5,85 => a = 0,075 mol
=> m = 0,075.27 + 0,075.137 = 12,3 gam
Đáp án B