Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Gọi số mol của CuSO4 và NaCl lần lượt là x và 3x (mol)
Thứ tự điện phân các chất tại catot và anot
Tại catot: Tại anot:
Cu2+ +2e → Cu↓ 2Cl- → Cl2 + 2e
2H2O + 2e → 2OH- + H2 2H2O → 4H+ + O2↑ + 4e
Vì nCl- = 3nCu2+ và chất tan thu được hòa tan được Al2O3 => Cl- điện phân hết.
2 chất tan thu được là Na2SO4 : x ( mol) ; NaOH: (3x – 2x) = x (mol)
2NaOH + Al2O3 → 2NaAlO2 + H2O
0,06 ← 0,03 (mol)
=> x = nNaOH = 0,06 (mol)
Tại catot: Cu: 0,06 mol; nH2 = a (mol)
Tại anot: Cl2: 0,09 mol; nO2 = b (mol)
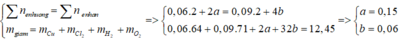
=> ∑ ne = 0,06.2 + 2.0,15 = 0,42 (mol)
Áp dung CT ta có: ne = It/F => t = 0,42.96500/2 = 20265 (s) = 5,63 (giờ)
Gần nhất với 5,6 giờ

Chọn B.
Hai chất tan là Na2SO4 (0,05 mol) và Al2(SO4)3 (0,05 mol)
Þ Dung dịch X chứa CuSO4: 0,2 mol và NaCl: 0,1 mol
Tại catot có Cu (0,2 mol) và H2 (a mol) và tại anot có Cl2 (0,05 mol) và O2 (b mol)
→ BT : e 2 a + 0 , 2 . 2 = 0 , 05 . 2 + 4 b và mdd giảm = 0,2.64 + 2a + 0,05.71 + 32b = 20,55
Þ a = 0,1 và b = 0,125. Vậy t = 6h.

Chọn B.
Dung dịch Y chứa NaOH và Na2SO4.
Đặt số mol của CuSO4 và NaCl lần lượt là x và 3x mol.
Khi cho Al tác dụng với dung dịch Y thì:


Giải thích: Đáp án A
Do dung dịch sau điện phân chứa 2 chất là: Na2SO4 và NaOH. Tỉ lệ mol CuSO4 và NaCl là 1:3 nên Cu2+ bị điện phân hết trước.
Al + OH-→AlO2-+ 1,5H2
=>nOH-=nH2/1,5=0,05 mol.
Quá trình điện phân:
Cu2+ + 2Cl- →Cu + Cl2
a 2a a a
2Cl- + 2H2O → Cl2 + H2 + 2OH-
a(=3a-2a) 0,5a 0,5a a=0,05
m giảm= 64a + 71a + 71.0,5a + 2.0,5a = 8,575 gam < 10,375
=> H2O bị điện phân: mH2O= 10,375-8,575 = 1,8 gam
H2O→H2+0,5O2
0,1 0,1 0,05 mol
Tại anot: 0,075 mol Cl2, 0,05 mol O2
=> ne= 0,075.2 + 0,05.4 = 0,35 mol=> t = ne.96500/I=0,35.96500/1,34=25205,2 giây = 7 giờ.
Chú ý: H2O bị điện phân

Giải thích: Đáp án D
Do dung dịch sau điện phân chứa 2 chất là: Na2SO4 và NaOH. Tỉ lệ mol CuSO4 và NaCl là 1:3 nên Cu2+ bị điện phân hết trước.
Al2O3+2OH- → 2AlO2-+H2O
=>nOH-=2nAl2O3=0,05 mol.
Quá trình điện phân:
Cu2+ + 2Cl- →Cu + Cl2
a 2a a a
2Cl- + 2H2O → Cl2 + H2 + 2OH-
a(=3a-2a) 0,5a 0,5a a=0,05
m giảm=64a+71a+71.0,5a+2.0,5a=8,575 gam<10,375
=> H2O bị điện phân: mH2O=10,375-8,575=1,8 gam
H2O→H2+0,5O2
0,1 0,1 0,05 mol
Tại anot: 0,075 mol Cl2, 0,05 mol O2
=> ne=0,075.2+0,05.4=0,35 mol=>t=ne.96500/I=0,35.96500/2,68=12602,6 giây=3,5 giờ.

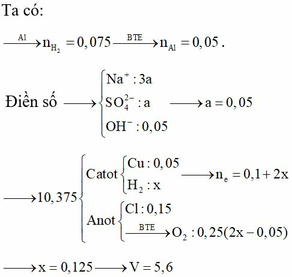
Vì 2nCuSO4 < nNaCl ⇒ Al2O3 bị hòa tan bởi OH–.
Ta có nAl2O3 = 0,025 mol ⇒ nOH– cần dùng = 0,05 mol.
⇒ nNaOH = 0,05 mol.
Vì Dung dịch chỉ chứa 2 chất tan ⇒ Cl– đã bị điện phân hết và 2 chất tan đó là Na2SO4 và NaOH.
⇒ mGiảm = mCu + mCl– + mH2
Û mGiảm = 0,05×64 + 0,15×35,5 + 0,05×1 = 8,575 < 10,375
⇒ Nước có điện phân (10,375 – 8,575) = 1,8 gam ⇒ nH2O = 0,1 mol.
⇒ ∑ne nhận = 2nCu + 2nH2 + 2nH2O = 0,1 + 0,05 + 0,2 = 0,35 mol.
⇒ t = ≈ 12602,6s ≈ 3,5 giờ
Đáp án D