


Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




Đáp án B
Theo giả thiết, bảo toàn nguyên tố C và bảo toàn electron, ta có :

n O2 = 1,6 / 32 = 0,05 (mol)
-> M X = 3,7 / 0,05 = 74 (g)
Nếu đốt cháy 1 g X thể tích CO2 không quá 0,7 lít
=> n CO2 = 0,7 / 22,4 = 1/32 = 0,03125
Từ đó số C trong hợp chất sẽ không quá : 1/74.n ≤ 0,03125
<=> n ≤ 2,3125
Nghĩa là có 2 trường hợp n = 1 và n = 2
TH1 : n = 1 ( Không có đáp án )
TH2 : n = 2 ( HOOC-CHO 2 Cacbon )

Chọn A
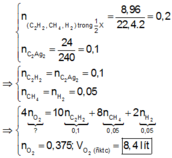
Ta có: n O 2 = 0 , 3 n C O 2 + H 2 O = 0 , 5
Giả sử X có 3 liên kết π

Đáp án là C
Y và Z là đồng phân nên X, Y cũng 2 chức
X, Y no nên Z, T cũng no
X,Y, Z, T có công thức chung là C n H 2 n - 2 O 4 ( e m o l )

X là C H 2 ( C O O H ) 2 ; Y là C 2 H 4 ( C O O H ) 2 ; Z là C 4 H 6 O 4 và T là C 5 H 8 O 4
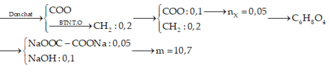
Từ Z và T tạo ra 3 ancol nên este có cấu tạo:
Z là ( H C O O ) 2 C 2 H 4 ( z m o l )
T là CH 3 - OOC - COO - C 2 H 5 ( t mol )
Các ancol gồm C 2 H 4 ( O H ) 2 ( z ) , C H 3 O H ( t ) , C 2 H 5 O H ( t )
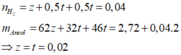
Đặt x,y là số mol X,Y
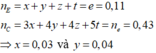
Muối lớn nhất là muối của Y:
C 2 H 4 ( C O O N a ) 2 : 0 , 04 m o l ⇒ m C 2 H 4 ( C O O N a ) 2 = 6 , 48 g a m

Trung hòa 11,8 gam một amin đơn chức cần 200 ml dung dịch HCL 1M. Công thức phân tử của X là bao nhiêu?

Đáp án C
Pt pư:
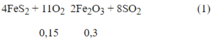
Ta có: nBaC03 = 0,15 mol
nKOH = 0,1 mol ⇒ nBa2+ = 0,15 mol ; nOH- = 0,4 mol
Khi cho SO2 vào dung dịch Y thu được 21,7 (g) BaSO3. Cho Y tác dụng với dung dịch NaOH thấy xuất hiện thêm kết tủa, chứng tỏ trong dung dịch Y có ion HSO3-.
Vì: Ba2+ + HSO3- + OH- " BaSO3 + H2O
Ta có: nBaC03 = 0,1 mol
Ptpứ:
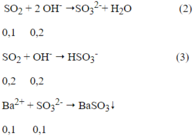
Ta có: nOH- = 0,4 - 0,2 = 0,2 mol
Theo ptpư (2), (3) ta có: n SO2= 0,1 + 0,2 = 0,3 mol
Theo ptpư (1) ta có: n FeS2 = ½ n SO2= 0,15 mol ⇒ m FeS2 = 120.0,15 = 18(g)