Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
CH3COOH + C2H5OH ⇋ CH3COOC2H5 + H2O.
Giả thiết cho: nCH3COOH = 0,2 mol; nC2H5OH = 0,3 mol; neste = 0,125 mol.
Có: 0,2 mol axit < 0,3 mol ancol
⇒ axit “ít dư” hơn so với ancol.
⇒ hiệu suất phản ứng tính theo axit,
H = 0,125 ÷ 0,2 = 62,5%.

Giải thích: Đáp án B
Phản ứng este hóa

Phản ứng theo tỉ lệ mol 1:1 → Hiệu suất tính theo CH3COOH


Đáp án A
Hướng dẫn CH3COOH + C2H5OH ⇄ H 2 S O 4 đ , t o CH3COOC2H5 + H2O
nCH3COOC2H5 theo pt = nCH3COOH = 0,4 mol
Mà nCH3COOC2H5 thực tế thu được = 0,3 mol
=> H = nCH3COOC2H5 thực tế thu được / nCH3COOC2H5 theo pt = 0,3 / 0,4 = 75%

Chọn đáp án D
Cứ 1 phân tử CH3COOH → 1 phân tử CH3COOC2H5.
+ Nhận thấy nCH3COOH = 0,2 mol và nCH3COOC2H5 = 0,125 mol
⇒ H = 0 , 125 0 , 2 × 100 = 62,5% ⇒ Chọn D

Đáp án C
Hướng dẫn Vì số mol ancol lớn hơn số mol axit nên ancol dư.
Số mol ancol pư = số mol axit = 0,2 mol
Áp dụng định luật bảo toàn khối lượng : mancol + maxit = meste + mnước
=> 0,2.46 + 12 = meste + 0,2.18 => meste = 17,6 gam
Nên H = 11.100 17 , 6 = 62,5%

Phương trình hóa học:
CH3COOH + C2H5OH ---H2SO4→ CH3COOC2H5 + H2O

Chọn đáp án D
Đặt nC2H5OH = x; nCH3COOH = y
⇒ 46x + 60y = 25,8(g).
Lại có:
DH2O = 1g/ml
⇒ nH2O = 23,4 × 1 ÷ 18 = 1,3 = 3x + 2y
⇒ Giải hệ có:
x = 0,3 mol; y = 0,2 mol
⇒ hiệu suất tính theo CH3COOH.
nCH3COOC2H5 = 14,08 ÷ 88 = 0,16 mol
⇒ H = 0,16 ÷ 0,2 × 100% = 80%.

Lời giải
Xét thí nghiệm 1 ta có: n C H 3 C O O H = 0 , 2 ( m o l ) ; n C 2 H 5 O H = 1 , 05 ( m o l )
Ta có kết tủa là BaSO4 n B a S O 4 = 0 , 02 ( m o l ) ; n H 2 S O 4 = 0 , 02 ( m o l )
Có n C O 2 = 0 , 09 ( m o l ) trong X có CH3COOH dư;
n C H 3 C O O H d ư = n C O 2 - 2 n H 2 S O 4 = 0 , 05 ( m o l ) ⇒ n e s t e = n H 2 O = 0 , 2 - 0 , 05 = 0 , 15 ( m o l ) ⇒ m e s t e = 13 , 2 ( g ) ; n C 2 H 5 O H = 1 , 05 - 0 , 15 = 0 , 9 ( m o l )
=> Khi ở trạng thái cân bằng ta có K C = 0 , 15 . 0 , 15 0 , 9 . 0 , 05 = 0 , 5
Ở thí nghiệm 2 ta có:
n C H 3 C O O H = 0 , 16 ( m o l ) ; n C 2 H 5 O H = 0 , 32 ( m o l ) ; n H 2 O t r o n g d d a x i t 19 30 ( m o l )
Ở trạng thái cân bằng, gọi n e s t e = x ( m o l )
⇒ n C H 3 C O O H = 0 , 16 - x ( m o l ) ; n C 2 H 5 O H = 0 , 32 - x ( m o l ) n H 2 O = 19 30 + x ( m o l )
. Vì KC không đổi
⇒ x 19 30 + x ( 0 , 16 - x ) ( 0 , 32 - x ) = 0 , 5 ⇒ x = 0 , 29
Vậy meste = 2,552(g)
Đáp án C.


Giải thích: Đáp án D
Ta có: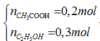 → hiệu suất tính theo CH3COOH
→ hiệu suất tính theo CH3COOH
PTTƯ:
Theo phản ứng thì