Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
nBa2+ = 0,012 < 0,02 = nSO42- ⇒ nBaSO4 = nBa2+ = 0,012
m↓ = mBaSO4 + mAl(OH)3 = 3,732g
⇒ nAl(OH)3 = 0,012
H+ + OH- → H2O
0,1 → 0,1 (mol)
Al3+ + 3OH- → Al(OH)3
z → 3z z (mol)
Al(OH)3 + OH- → AlO2- + H2O
Z – 0,12 → z – 0,12 (mol)
nOH- ban đầu = 0,168 = nH+ + 3nAl3+ + nAlO2- = 0,1 + 3z + z – 0,012
⇒ z = 0,02
Bảo toàn điện tích: 3z + 0,1 = t + 0,02.2 ⇒ t =0,12

\(n_{OH^-}=0.12\cdot\left(1.2+0.1\cdot2\right)=0.168\left(mol\right)\)
Trong dung dịch X, bảo toàn điện tích :
\(0.1+3z=t+0.02\cdot2\)
\(\Rightarrow t-3z=0.06\left(1\right)\)
Khi cho dung dịch X và dung dịch Y phản ứng thì :
\(H^++OH^-\rightarrow H_2O\)
\(0.1.......0.1\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.012.....0.012............0.012\)
=> SO42- dư
\(m_{BaSO_4}=0.012\cdot233=2.796\left(g\right)\)
\(\Rightarrow n_{Al\left(OH\right)_3}=\dfrac{3.732-2.796}{78}=0.012\left(mol\right)\)
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\)
\(n_{OH^-}\)phản ứng với \(Al\left(OH\right)_3\)\(=0.168-0.1=0.068\left(mol\right)< 3n_{Al\left(OH\right)_3}\)
\(\Rightarrow n_{Al^{3+}}=\dfrac{n_{Al\left(OH\right)_3}+n_{OH^-}}{4}=\dfrac{0.012+0.068}{4}=0.02\left(mol\right)\)
\(\Rightarrow z=0.02\)
\(\left(1\right):t=0.12\)

$n_{OH^-} = 0,12.1,2 + 0,12.0,1.2 = 0,168(mol)$
$n_{Ba^{2+}} = 0,012 < n_{SO_4^{2-}} = 0,02$ nên $SO_4^{2-}$ dư
$n_{BaSO_4} = n_{Ba^{2+}} = 0,012(mol)$
$\Rightarrow n_{Al(OH)_3} = \dfrac{3,732 - 0,012.233}{78} = 0,012(mol)$
Al3+ + 3OH- → Al(OH)3
z............3z...............z................(mol)
Al(OH)3 + OH- → AlO2- + 2H2O
z-0,012.....z-0,012.................................(mol)
Suy ra: 3z - (z - 0,012) = 0,168
Suy ra: z = 0,078
Bảo toàn điện tích, t = 0,294

Bảo toàn điện tích : 0,1 + 3z = t + 0,02.2 → t-3z = 0,06
Nhận thấy kết tủa gồm BaSO4 : 0,012 mol, Al(OH)3: 0,012 mol
Ta có 3×nkết tủa + nH+ = 0,136 mol < nOH- = 0,168 mol → Xảy ra trường hợp hòa tan kết tủa
H+ + OH- → H2O
0,1 ------> 0,1
Al3+ + 3OH- → Al(OH)3
0,012---0,036 ------> 0,012
Al3+ + 4OH- → Al(OH)4-
0,008----> 0,032
Vậy z= 0,012 + 0,008 =0,02 → t= 0,12. Đáp án B

Đáp án C
Bảo toàn điện tích: 2x = 0,05 + 0,12 – 0,12 ⇒ x = 0,025
Ba2+ + SO42- → BaSO4
0,025 ← 0,025 → 0,025 (mol)
NH4+ + OH- → NH3 + H2O
0,05 → 0,05 → 0,05 0,05 ( mol)
mchất rắn = mX + mBa(OH)2 – mBaSO4 – mNH3 – mH2O = 7,875g

Đáp án A
Bảo toàn điện tích suy ra x = 0,025 mol
Ba2++ SO42-→BaSO4
0,03 0,025 0,025
OH-+ NH+4→ NH3+ H2O
0,06 0,05
Dung dịch Y có 0,12 mol Na+; 0,12 mol Cl-; 0,005 mol Ba2+; OH- 0,01 mol
Khi cô cạn thu được m = 0,12.23+ 0,12.35,5+ 0,005.137+ 0,01.17 = 7,875 gam

Nhận thấy 36,9 gam kết tủa gồm BaSO4 : 0,15 mol và Al(OH)3 : 0,025 mol
Vì nAl(OH)3 = 0,025 mol < <nOH- = 0,3 + 0,3x mol → xảy ra hiện tượng hòa tan kết tủa
Al3+ + 3OH- → Al(OH)3
Al3+ + 4OH- → Al(OH)4-
Luôn có 4nAl3+ = nOH- + nAl(OH)3 → nOH- = 0,3 + 0,3x = 4×0,1 -0,025= 0,375 mol → x= 0,25 mol
→ Đáp án B



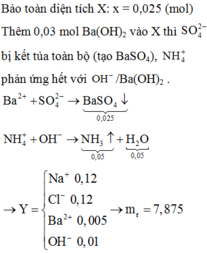

Chọn D
Bảo toàn điện tích có: 0,07 + 3a = 0,12 + 0,02.2 → a = 0,03 mol
Cho X vào hỗn hợp KOH và Ba(OH)2:
Sau phản ứng thu được kết tủa là:
BaSO 4 0,012 (mol) và Al ( OH ) 3 : 0,03 – 0,008 = 0,022 (mol).
m↓ = 0,012.233 + 0,022.78 = 4,512 gam.