Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án A
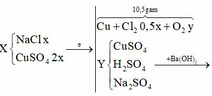
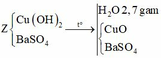
Cho Ba(OH)2 vào dung dịch X thu được kết tủa, lấy kết tủa này nung nóng thì khối lượng giảm chứng tỏ trong kết tủa có Cu(OH)2 Þ nCu2+ trong Y = nH2O bay ra = 2,7/18 = 0,15 mol
Cu2+ dư, mà có hỗn hợp khí thoát ra Þ Hỗn hợp khí này gồm Cl2 và O2 (do Cl- đã hết)
Gọi x là số mol NaCl Þ 2x là số mol CuSO4, gọi y là số mol O2 sinh ra
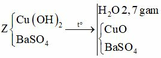
Vậy V=(0,12/2+0,015)x22,4=1,68

Đáp án B
Ta có: n C u S O 4 . 5 H 2 O = 0 , 24 m o l
Điện phân X đến khi dung dịch giảm 24,88 gam thì dừng. Dung dịch thu được 2 chất tan. Cho Mg vào Y thấy thành Mg giảm 3,36 gam chứng tỏ có H+.
Do vậy hai chất tan trong Y là H2SO4 và Na2SO4
n H 2 S O 4 = n M g = 0 , 14 m o l
Cu2+ bị điện phân hết và có sinh ra 0,28 mol H+ → n C l 2 = 0 , 24 . 2 - 0 , 28 2 = 0 , 1
Dung dịch bị giảm do Cu2+, Cl- và H2O bị điện phân.
Gọi số mol H2 tạo ra ở catot là x → n O 2 = 2 x + 0 , 24 . 2 - 0 , 1 . 2 4 = 0 , 5 x + 0 , 07 → 0 , 24 . 64 + 2 x + 0 , 2 . 35 , 5 + 32 ( 0 , 5 x + 0 , 07 ) = 24 , 88
Giải được: x=0,01.
Vậy ở anot thu được 0,1 mol Cl2 và 0,075 mol O2.
=> V= 3,92

Đáp án B
Ở anot thu được hỗn hợp khí gồm Cl2 và O2, dựa vào tỉ khối ta có tỉ lệ số mol 2 khí này là 6:1.
Gọi số mol O2 là x mol suy ra số mol Cl2 là 6x.
Ở catot thu được Cu 8x mol.
Khối lượng dung dịch giảm là do O2, Cu, Cl2 thoát ra → 32x+64.8x+71.6x = 29,1
Giải được: x=0,03
→ b = 6x.2 = 0,36
Khối lượng kim loại Cu bàm vào catot là 158,36 gam.
Cho Ba(OH)2 dư vào dung dịch sau điện phân kết tủa thu được gồm a mol BaSO4 và a-0,24 mol Cu(OH)2.
→ 233a + (a - 0,24).98 = 135,36
Giải được a=0,48.
Khối lượng chất tan trong X là 97,86 gam.
4,68 gam hỗn hợp Al và Mg có tỉ lệ số mol 2:1 gồm có 0,12 mol Al và 0,06 mol Mg.
Ta có: 0,12.3+0,06.2 = 0,18.2+0,03.4 nên lượng khí oxi hóa vừa đủ.
Điện phân X trong 20072 giây tức số mol e là 1,04 mol.
Ở catot thu được Cu 0,48 mol và H2 0,04 mol.
Ở anot thu được Cl2 0,18 mol và O2 0,17 mol.
Tổng số mol khí thoát ra là 0,39 mol

Đáp án : B
Điện phân hỗn hợp. CuSO4 x mol , NaCl 3x mol.
- Thứ tự điện phân trong dung dịch :
Cu2+ + 2Cl- à Cu↓ + Cl2 ↑ (1)
(mol) x 2x x x
hết Cu2+ : 2Cl- + 2H2O à 2OH- + H2 ↑ + Cl2 ↑ (2)
(mol) x x 0,5x 0,5x
Dung dịch Y chứa hai chất tan là Na2SO4 và NaOH => Hết ion Cl-
- Tính số mol OH- theo số mol H2:
2Al + 2OH- + 2H2O à 2AlO2- + 3H2 ↑
(mol) x = 0,05 ß---------------------0,075
- Khối lượng dung dịch giảm:
64.0,05 + 71.0,05 + 71.0,5.0,05 + 2.0,5.0,05 = 8,575 < 10,375 gam => H2O bị điện phân
Khối lượng H2O bị điện phân : 10,375 – 8,575 = 1,8 gam , số mol H2O bị điện phân 0,1 mol.
- Phương trình điện phân của H2O :
2H2O → N a O H d p d d 2H2↑ + O2↑ (3)
(mol) 0,1 0,1 0,05
- tính số mol electron trao đổi anot : Cl2 (0,075 mol, O2 (0,05 mol).
Số mol electron trao đổi = 2.0,075 + 4.0,05 = 0,35 mol.
Hoặc tại catot : Cu (0,05 mol) , H2 (0,025 + 0,1) mol cũng tương tự
Số mol electron trao đổi = 2.0,05 + 2.0,125 = 0,35 mol.
ne = It/26,8 , thay số : 0,35 = 1,34t/26,8 => t = 7.


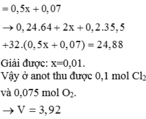
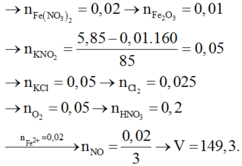
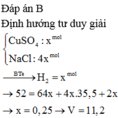


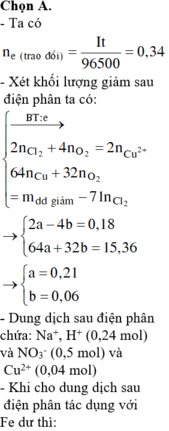


Chọn đáp án B
Cho Ba(OH)2 vào dung dịch X thu được kết tủa, lấy kết tủa này nung nóng thì khối lượng giảm chứng tỏ trong kết tủa có Cu(OH)2 Þ nCu2+ trong Y = nH2O bay ra = 2,7/18 = 0,15 mol
Cu2+ dư, mà có hỗn hợp khí thoát ra Þ Hỗn hợp khí này gồm Cl2 và O2 (do Cl- đã hết)
Gọi x là số mol NaCl Þ 2x là số mol CuSO4, gọi y là số mol O2 sinh ra