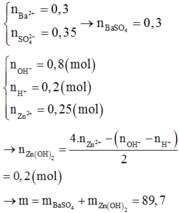Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(\Sigma n_{H^+}=0,1.0,1.2+0,1.0,2=0,04\left(mol\right)\)
\(\Sigma n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04\left(mol\right)\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
_____0,04____0,04_________ (mol)
⇒ H+ pư vừa đủ với OH-
⇒ a = pH = 7
Ta có: \(n_{SO_4^{2-}}=0,1.0,1=0,01\left(mol\right)\)
\(n_{Ba^{2+}}=0,1.0,1=0,01\left(mol\right)\)
PT ion: \(SO_4^{2-}+Ba^{2+}\rightarrow BaSO_{4\downarrow}\)
_______0,01___0,01______0,01___ (mol)
\(\Rightarrow m=m_{BaSO_4}=0,01.233=2,33\left(g\right)\)
Bạn tham khảo nhé!

Đáp án A
Chú ý đổ từ từ muối Na2CO3 và NaHCO3 vào dung dịch H2SO4 thì xảy ra đồng thời các phương trình ( HSO4- coi như chất điện ly hoàn toàn tạo ra SO42- và H+)
2H+ + CO32- → CO2 + H2O (1)
2x------> x
H+ + HCO3- → CO2 + H2O (2)
y -----> y
Ta có 2x+ y = 0,08 mol
Vì phản ứng xảy ra đồng thời nên x: y = nCO32- : nHCO3- = 0,06 : 0,03 = 2:1
Ta có hệ 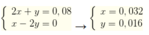
Vậy nCO2 = 0,032 + 0,016 = 0,048 mol → V= 1,0752 l
Vậy dung dịch X chứa : HCO3- dư : 0,014 mol, CO32- :0,028 mol, SO42-:0,06 mol
Khi cho 0,15 mol BaCl2 và 0,06 mol KOH vào dung dịch X xảy ra các pt sau:
HCO3- + OH- → CO32- + H2O
0,014--- 0,06 ----> 0,014
Ba2+ + CO32- → BaCO3↓
0,15 ----0,042 ----> 0,042
SO42- + Ba2+ → BaSO4↓
0,06---------------> 0,06
Vậy mkết tủa = 0,06×233+ 0,042×197 = 22,254 gam

`100mL=0,1L`
`n_{H^+}=0,1.0,05.2+0,1.0,1=0,02(mol)`
`n_{SO_4^{2-}}=0,1.0,05=0,005(mol)`
`n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04(mol)`
`n_{Ba^{2+}}=0,1.0,1=0,01(mol)`
`Ba^{2+}+SO_4^{2-}->BaSO_4`
Do `0,01>0,005->` Tính theo `SO_4^{2-}`
`n_{BaSO_4}=n_{SO_4^{2-}}=0,005(mol)`
`->m_↓=0,005.233=1,165(g)`
`H^{+}+OH^{-}->H_2O`
Do `0,02<0,04->OH^-` dư
`n_{OH^{-}\ pu}=n_{H^+}=0,02(mol)`
`->n_{OH^{-}\ du}=0,04-0,02=0,02(mol)`
Trong X: `[OH^-]={0,02}/{0,1+0,1}=0,1M`
`->pH=14-pOH=14+lg[OH^-]=13`

Đáp án D
VX = 0,3 lit
=> Thể tích mỗi dung dịch axit thành phần là 0,1 lit
=> nH+ = nHCl + 2nH2SO4 + 3nH3PO4 = 0,1.0,3 + 2.0,1.0,2 + 3.0,1.0,1 = 0,1 mol
Để trung hòa thì : nH+ = nOH- = 0,1 mol
Có : nOH- = nNaOH + 2nBa(OH)2 = (0,2 + 0,1.2).V.10-3 = 0,1 mol
=> V = 250 ml

Chọn B
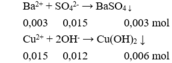
Khối lượng kết tủa là: m = 0,003.233 + 0,006.98 = 1,287 gam.

Chọn D
Trộn 3 dung dịch với thể tích bằng nhau thu được 150 ml dung dịch X → mỗi dung dịch lấy 50ml.
→ n H + = 0,05.0,2 + 0,05.2.0,1 + 0,05.0,08 = 0,024 mol.
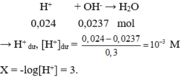

Đáp án B
nH+ = 0,1 .2.0,05 + 0,1.0,1 =0,02
nOH- = 0,1.0,2 + 0,1.0,1.2 = 0,04
⇒ Trong dung dịch sau phản ứng có nOH- dư = 0,04 – 0,02 = 0,02 mol
V dd thu = 100 + 100 = 200ml
⇒ [OH-] = 0,1 ⇒ pH = 13
Đáp án B.

Đáp án B
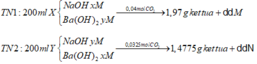
Do dd M và dd N đều tác dụng với KHSO4 sinh ra kết tủa nên dd M và dd N đều chứa Ba(HCO3)2