Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`-` Khi hình thành liên kết cộng hóa trị trong phân tử `CO_2`, các nguyên tử đã liên kết với nhau như sau:
Mỗi nguyên tử `C` và `O` lần lượt có `12e` và `16e`. Để hình thành phân tử `CO_2`, nguyên tử `C` đã liên kết với `2` nguyên tử `O` bằng cách nguyên tử `C` góp chung với mỗi nguyên tử `O` là `2e` ở lớp ngoài cùng tạo thành các cặp electron dùng chung.
`NH_3`
Mỗi nguyên tử `N` và `H` lần lượt có `14e` và `1e`. Để hình thành phân tử ammonia, nguyên tử `N` liên kết với nguyên tử `H` bằng cách nguyên tử `N` góp chung với nguyên tử `H` là `1e` ở lớp ngoài cùng tạo thành `3` cặp electron dùng chung.

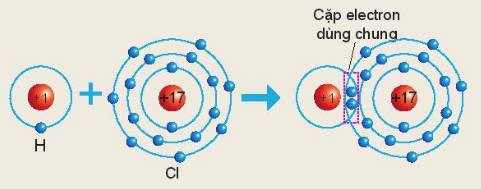
Nguyên tử `Cl` dùng chung `1` cặp electron với nguyên tử `H`
`->` Trong phân tử muối `HCl,` nguyên tử nguyên tố `Cl` sẽ có hóa trị là `I`.

`Cl_2`
Mỗi nguyên tử `Cl` có `7e` ở lớp ngoài cùng. Để có cấu trúc electron bền vững giống khí hiếm `Ar`, `2` nguyên tử `Cl` đã liên kết với nhau bằng cách mỗi nguyên tử `Cl` góp chung `1e` ở lớp ngoài cùng tạo thành `1` cặp electron dùng chung.
`N_2`
Mỗi nguyên tử `N` có `5e` ở lớp ngoài cùng. Để có cấu trúc electron bền vững giống khí hiếm `Ne`,`2` nguyên tử `N` đã liên kết với nhau bằng cách mỗi nguyên tử `N` góp chung `3e` ở lớp ngoài cùng tạo thành `3` cặp electron dùng chung.

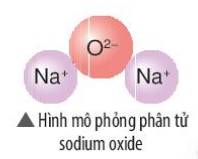
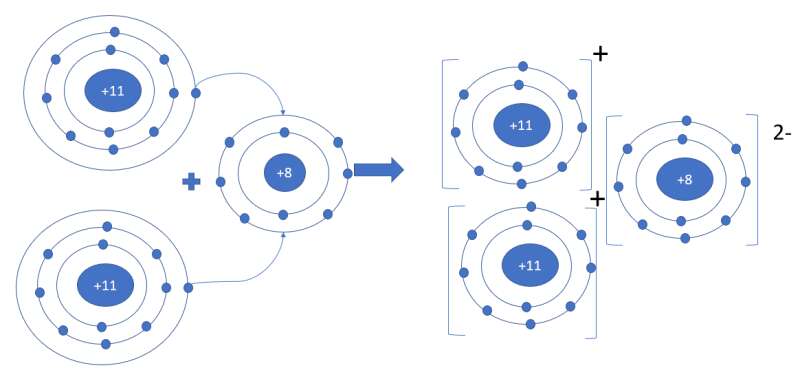
- Sodium oxide gồm 2 nguyên tố: Na (kim loại) và O (phi kim)
=> Liên kết ion
- Nguyên tử Na (số hiệu nguyên tử = 11) nhường 1 electron => Ion Na+
- Nguyên tử O (số hiệu nguyên tử = 8) nhận 2 electron => Ion O2-

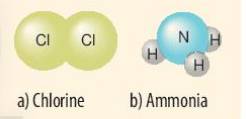
- Xét phân tử khí chlorine
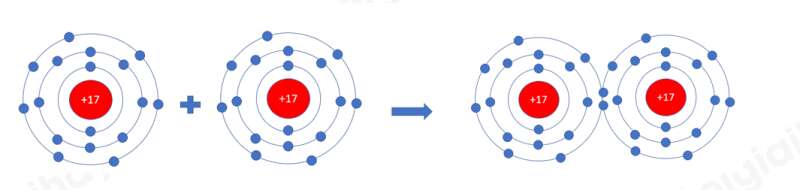
=> Mỗi nguyên tử Cl có 7 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ar, khi hình thành phân tử chlorine, hai nguyên tử Cl đã liên kết với nhau bằng cách mỗi nguyên tử Cl góp chung 1 electron tạo thành 1 cặp electron dùng chung
- Xét phân tử khí amonia
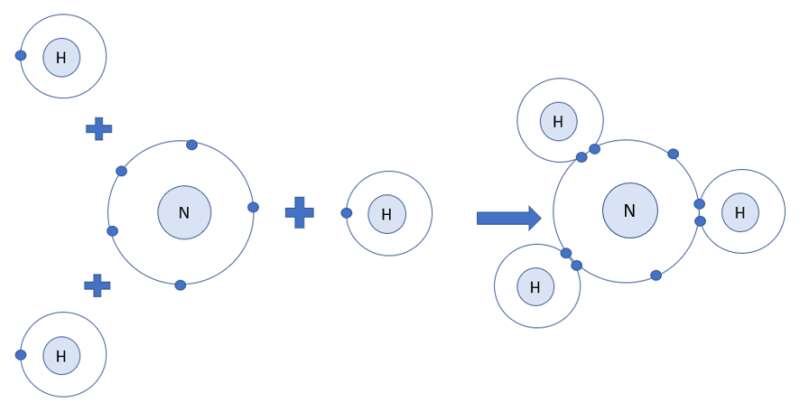
- Nguyên tử H có 1 electron ở lớp ngoài cùng
- Nguyên tử N có 5 electron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và N cần thêm 3 electron để đạt cấu hình electron bền vững của khí hiếm
=> Khi 3 nguyên tử H và 1 nguyên tử N liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử N góp ra 3 electron để tạo ra 3 đôi electron dùng chung

- Quá trình tạo thành liên kết cộng hóa trị trong phân tử hydrogen:
+ Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử H liên kết với nhau, mỗi nguyên tử góp chung 1 electron để tạo ra đôi electron dùng chung.
+ Hạt nhân của hai nguyên tử H cùng hút đôi electron dùng chung và liên kết với nhau tạo thành phân tử hydrogen.
- Quá trình tạo thành liên kết cộng hóa trị trong phân tử oxygen:
+ Nguyên tử O có 6 electron lớp ngoài cùng, cần thêm 2 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử O liên kết với nhau, mỗi nguyên tử góp 2 electron để tạo ra hai cặp electron dùng chung.
+ Hạt nhân của hai nguyên tử O cùng hút các cặp electron dùng chung và liên kết với nhau tạo thành phân tử oxygen.

tham khảo
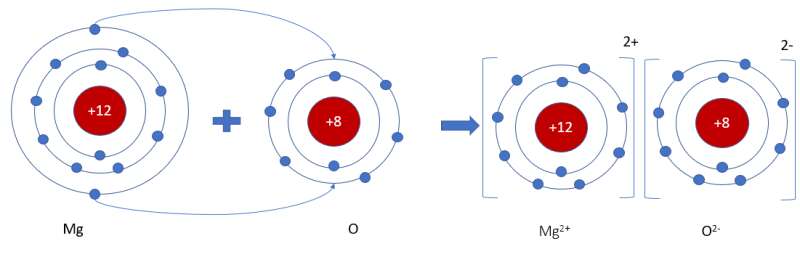
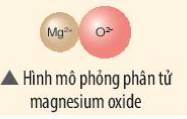
- Nguyên tử Mg (có số hiệu nguyên tử = 12) nhường 2 electron cho O, tạo thành ion Mg2+
- Nguyên tử O (có số hiệu nguyên tử = 8) nhận 2 electron từ Mg, tạo thành ion O2-
=> Ion dương Mg2+ và ion âm O2- mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion
- Sơ đồ mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide: