Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol H 2 S O 4 trong 100ml dung dịch 0,5M là :
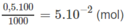
Số mol NaOH trong 33,4 ml nồng độ 1M :
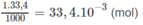
H 2 S O 4 + 2NaOH → N a 2 S O 4 + 2 H 2 O
Lượng H 2 S O 4 đã phản ứng với NaOH :

Số mol H 2 S O 4 đã phản ứng với kim loại là :
5. 10 - 2 - 1.67. 10 - 2 = 3,33. 10 - 2 mol
Dung dịch H 2 S O 4 0,5M là dung dịch loãng nên :
X + H 2 S O 4 → X S O 4 + H 2 ↑
Số mol X và số mol H 2 S O 4 phản ứng bằng nhau, nên :
3,33. 10 - 2 mol X có khối lượng 0,8 g
1 mol X có khối lượng: 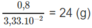
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.

- Khi cho hh kim loại tác dụng với HNO3 đặc nguội thì Al không phản ứng, chỉ có kim loại R phản ứng, tạo khí là NO2.
Áp dụng bảo toàn e:
n e (do R nhường) = nNO2 = 0,6 mol
- Khi cho hh kim loại phản ứng với HNO3 loãng thì cả 2 kim loại phản ứng:
Áp dụng bảo toàn e:
n e (do Al) + n e (do R) = 3nNO
→ 3.nAl + 0,6 = 3.0,6 → nAl = 0,4 mol
a)
mAl = 0,4.27 = 10,8 gam
mR = 30 - 10,8 = 19,2 gam
b)
nR = 1/2.n e (do R) = 0,3 mol
→ MR = mR : nR = 19,2 : 0,3 = 64
Vậy kim loại còn lại là đồng (Cu)

X gồm 2 khí không màu, không hóa nâu ngoài không khí và là sản phẩm khử của N nên X là N2, N2O
Đặt nN2= x mol; nN2O= y mol
Ta có nX= x+ y= 0,075 mol
mX= nX.MX= 0,075.17,2.2= 28x+ 44y
Giải hệ trên có : x= 0,045 ; y=0,03
QT nhận e :
2NO3-+ 8e+ 10H+ → N2O + 5H2O (1)
0,24 0,3 ← 0,03 mol
2NO3-+ 10e+12H+→ N2+ 6H2O (2)
0,45 0,54← 0,045
Theo PT (1), (2): nH+= 0,3+0, 54= 0,84 mol= nHNO3→ Vdd HNO3= 4,2 lít
QT cho e:
M → Mn++ ne
0,69/n 0,69 mol
Theo ĐL bảo toàn e : ne cho = ne nhận= 0,24+0,45= 0,69 mol
MM= mM/nM= 6,21 : 0,69/n=9n
Xét n=1, 2, 3 thì thấy chỉ có n=3, M=27 (Al) thỏa mãn
Đáp án D

1) Gọi x là hóa trị cao nhất của M
\(n_{NO}=\frac{4,48}{22,4}=0,2\left(mol\right)\); \(n_M=\frac{19,2}{M_M}\left(mol\right)\)
Có: \(M^0-xe\rightarrow M^{+x}\)
__ \(\frac{19,2}{M_M}\) --> \(\frac{19,2x}{M_M}\) -> \(\frac{19,2}{M_M}\)
=> Số mol e nhường: \(\frac{19,2x}{M_M}\)
Có: \(N^{+5}+3e\rightarrow N^{+2}\)
_________ 0,6 <--- 0,2
=> Số mol e nhận: 0,6
Áp dụng DDLBT e => \(\frac{19,2x}{M_M}=0,6=>M_M=32x\)
Xét x =1 => \(M_M=32\) k có
Xét x =2 => \(M_M=64=>\) M là Cu
Chất rắn cuối cùng thu được là CuO
=> \(m_{CuO}=\frac{19,2}{64}.80=24\left(g\right)\)
2) Gọi số mol NO và N2 lần lượt là a,b (mol)
Ta có: \(\left\{{}\begin{matrix}\frac{30a+28b}{a+b}=28,8\\a+b=0,125\end{matrix}\right.\) => \(\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,075\left(mol\right)\end{matrix}\right.\)
\(n_X=\frac{8,1}{M_X}\left(mol\right)\)
Có: \(X^0-3e\rightarrow X^{+3}\)
___ \(\frac{8,1}{M_X}\) -> \(\frac{24,3}{M_X}\)
Có: \(N^{+5}+3e\rightarrow N^{+2}\)
_________ 0,15 <- 0,05
\(2N^{+5}+10e\rightarrow N_2^0\)
_______ 0,75 <- 0,075
Áp dụng ĐLBT e => \(\frac{24,3}{M_X}=0,15+0,75\) => \(M_X=27\) => M là Al
\(m_{HNO_3}=0,5.2,5.63=78,75\left(mol\right)\)
m dd HNO3 = \(2500.12,5=31250\left(g\right)\)
=> C% = \(\frac{78,75}{31250}.100\%=0,252\%\)



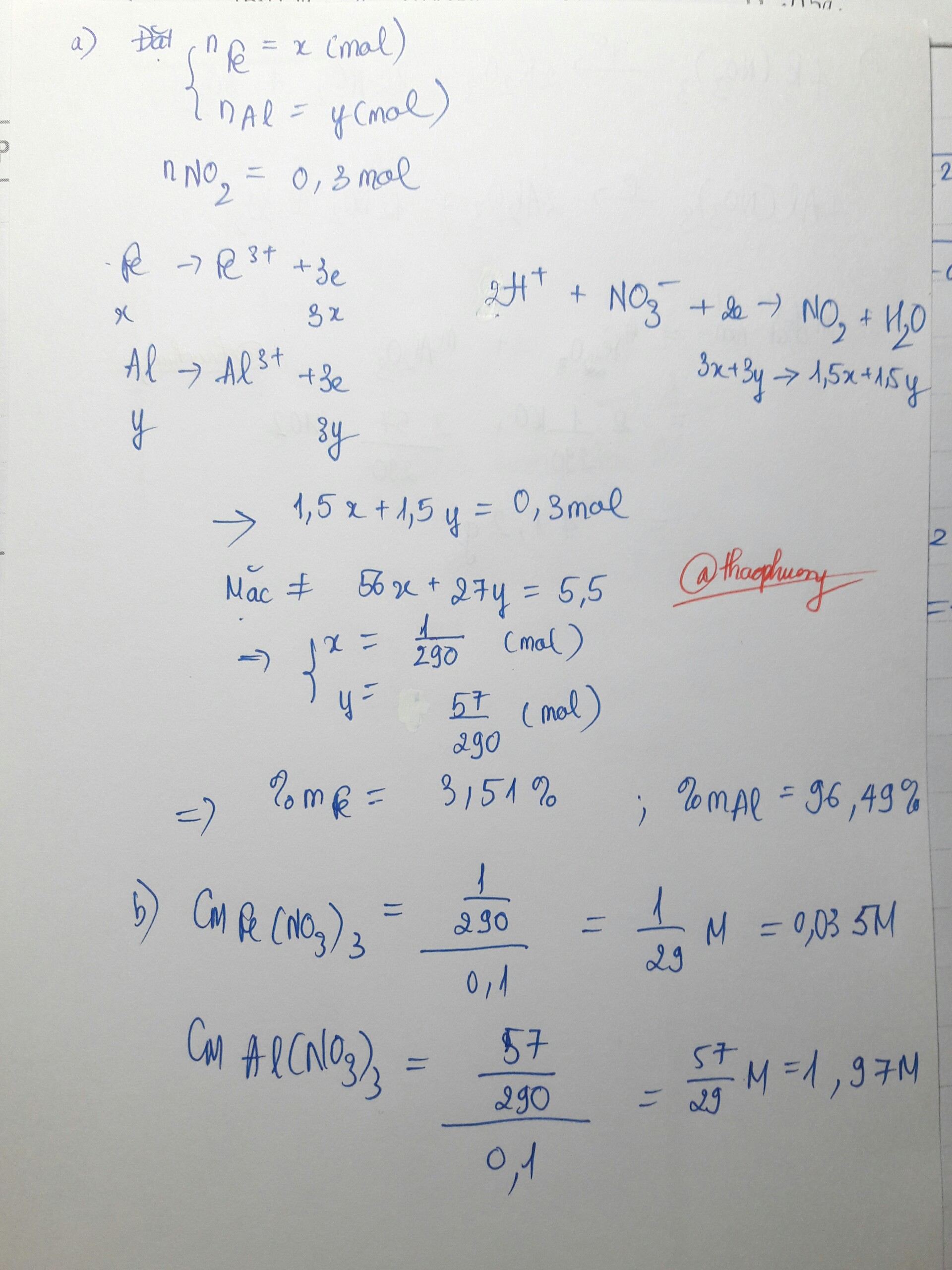
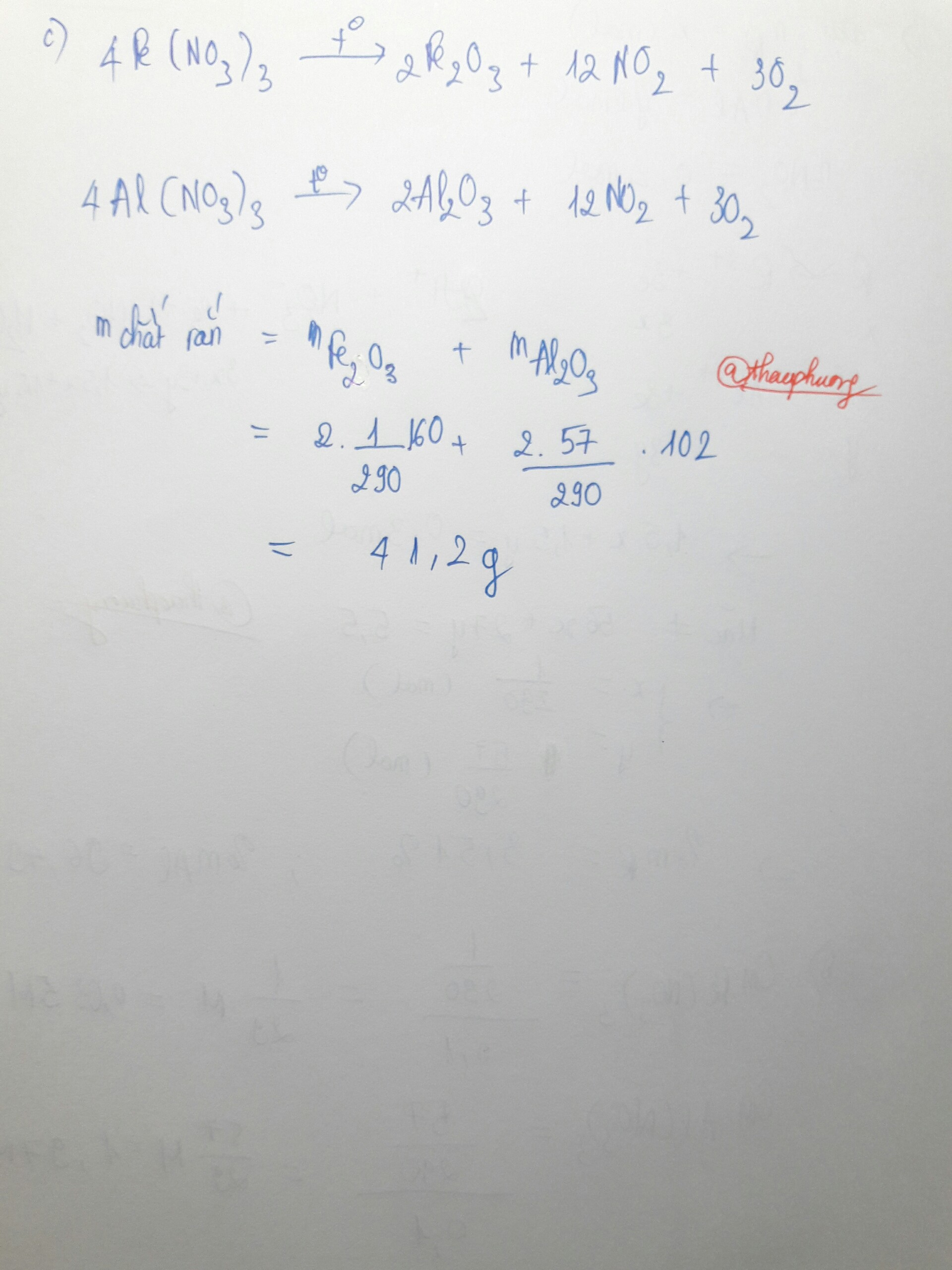

Đáp án: A.
Phương trình hóa học:
Số mol khí N O 2 :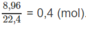
Theo phương trình hoá học :
n M = 0,2 mol và
Khối lượng mol nguyên tử của kim loại M :
⇒ kim loại là Cu (đồng).
Gọi V (ml) là thể tích của dung dịch H N O 3 60,0%. Ta có phương trình liên hệ V với n H N O 3 :
⇒ V = 61,5 ml