Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)

\(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
0,07 0,14 0,07 0,07
\(nCO_2=\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
\(nNaOH=\dfrac{6,4}{23+17}=0,16\left(mol\right)\)
LTL : \(\dfrac{0,07}{1}< \dfrac{0,16}{2}\)
=> NaOH dư , CO2 đủ
\(nNaOH_{\left(dư\right)}=0,16-0,14=0,02\left(mol\right)\)
\(mNaOH_{\left(dư\right)}=0,02.40=0,8\left(g\right)\)

nZn=19,5/65=0,3(mol)
mHCl=18,25/36,5=0,5(mol)
pt: Zn+2HCl--->ZnCl2+H2
1______2
0,3_____0,5
Ta có: 0,3/1>0,5/2
=>Zn dư
mZn dư=0,05.65=3,25(mol)
Theo pt: nH2=1/2nHCl=1/2.0,5=0,25(mol)
=>VH2=0,25.22,4=5,6(l)
nZn = 0,3 mol
nHCl = 0,5 mol
Zn + 2HCl → ZnCl2 + H2
Đặt tỉ lệ ta có
0,3 < \(\dfrac{0,52}{2}\)
⇒ Zn dư và dư 3,25 gam
⇒ VH2 = 0,25.22,4 = 5,6 (l)

a) \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,25 0,5 0,5 0,5
Xét tỉ lệ : \(\dfrac{0,3}{1}>\dfrac{0,5}{2}\) => Zn dư , HCl đủ
b) \(m_{Zn\left(dư\right)}=\left(0,3-0,25\right).65=3,25\left(g\right)\)
c) \(m_{ZnCl_2}=0,25.136=34\left(g\right)\)
\(V_{H_2}=0,25.22,4=5,6\left(l\right)\)
\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\ n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\\ a,Zn+2HCl\rightarrow ZnCl_2+H_2\\b, Vì:\dfrac{0,5}{2}< \dfrac{0,3}{1}\Rightarrow Zndư\\ n_{Zn\left(dư\right)}=0,3-\dfrac{0,5}{2}=0,05\left(mol\right)\\ \Rightarrow m_{Zn\left(dư\right)}=0,05.65=3,25\left(g\right)\\ c,n_{ZnCl_2}=n_{H_2}=\dfrac{0,5}{2}=0,25\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,25.136=34\left(g\right)\\ V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\)

nFe = 2.8/56 = 0.05 (mol)
nHCl = 14.6/36.5 = 0.4 (mol)
Fe + 2HCl => FeCl2 + H2
1.........2
0.05......0.4
LTL : 0.05/1 < 0.4/2
=> HCl dư
mHCl (dư) = ( 0.4 - 0.1 ) * 36.5 = 10.95 (g)
VH2 = 0.05*22.4 = 1.12 (l)
nHCl (dư) = 0.4 - 0.1 = 0.3 (mol)
mFe cần thêm = 0.3/2 * 56 = 8.4 (g)

a) PTHH: \(BaCO_3+2HCl\rightarrow BaCl_2+H_2O+CO_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{BaCO_3}=\dfrac{68,95}{197}=0,35\left(mol\right)\\n_{HCl}=0,25\cdot3,2=0,8\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,35}{1}< \dfrac{0,8}{2}\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow n_{HCl\left(dư\right)}=0,8-0,35\cdot2=0,1\left(mol\right)\) \(\Rightarrow m_{HCl\left(dư\right)}=0,1\cdot36,5=3,65\left(g\right)\)
b+c) Theo PTHH: \(\left\{{}\begin{matrix}n_{CO_2}=n_{BaCl_2}=0,35\left(mol\right)\\n_{HCl\left(dư\right)}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{CO_2}=0,35\cdot22,4=7,84\left(l\right)\\C_{M_{BaCl_2}}=\dfrac{0,35}{0,25}=1,4\left(M\right)\\C_{M_{HCl\left(dư\right)}}=\dfrac{0,1}{0,25}=0,4\left(M\right)\end{matrix}\right.\)

\(n_{HCl}=\dfrac{100.7,3\%}{36,5}=0,2\left(mol\right)\\ a,PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ b,n_{Zn}=n_{H_2}=n_{ZnCl_2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ m=m_{Zn}=0,1.65=6,5\left(g\right)\\ c,V_{H_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\\ d,m_{ddZnCl_2}=6,5+100-0,1.2=106,3\left(g\right)\\ C\%_{ddZnCl_2}=\dfrac{0,1.136}{106,3}.100\approx12,794\%\)

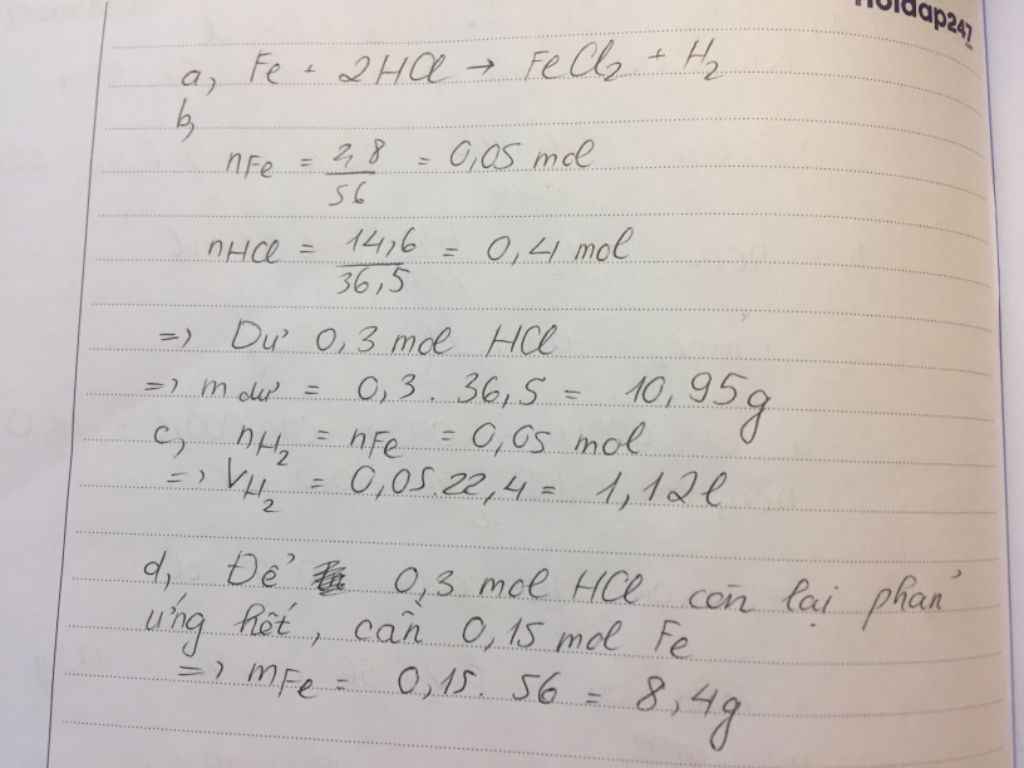

a,\(n_{H_2SO_4}=2.0,15=0,3\left(mol\right);n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: 0,3 0,3 0,3
b,Ta có: \(\dfrac{0,4}{1}>\dfrac{0,3}{1}\) ⇒ Zn dư , H2SO4 pứ hết
⇒ mZn dư = (0,4-0,3).65 = 6,5 (g)
c,\(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(n_{H_2SO_4}=0,15.2=0,3\left(mol\right)\\ n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\\ a.Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ b.Vì:\dfrac{0,3}{1}< \dfrac{0,4}{1}\\ \rightarrow Zndư\\ n_{Zn\left(p.ứ\right)}=n_{H_2}=n_{H_2SO_4}=0,3\left(mol\right)\\ n_{Zn\left(DƯ\right)}=0,4-0,3=0,1\left(mol\right)\\ m_{Zn\left(dư\right)}=0,1.65=6,5\left(g\right)\\ c.V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\)
Anh thấy dạng này khá đơn giản, em nên học cách làm rồi tự làm nha! Có gì không hiểu hỏi lại nha em