Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{HCl}=0.5\cdot1=0.5\left(mol\right)\)
\(n_{H_2SO_4}=0.5\cdot0.28=0.14\left(mol\right)\)
\(\Rightarrow n_{H^+}=0.5+0.14\cdot2=0.75\left(mol\right)\)
\(n_{H_2}=\dfrac{8.736}{22.4}=0.39\left(mol\right)\)
\(Mg+2H^+\rightarrow Mg^{2+}+H_2\)
\(2Al+6H^+\rightarrow2Al^{3+}+3H_2\)
\(n_{H_2}>2n_{H^+}\)
=> Đề sai

1/ nH2 = 0,39 mol; nHCl = 0,5 mol; nH2SO4 = 0,14 mol
nH+= 0,5 + 0,14.2 = 0,78 = 2nH2
=> axit phản ứng vừa đủ
Bảo toàn khối lượng: mkim loại + mHCl + mH2SO4 = mmuối khan + mH2
=> mmuối khan = 7,74 + 0,5.36,5 + 0,14.98 – 0,39.2 = 38,93 gam
2/ Đặt x, y là số mol Mg, Al
\(\left\{{}\begin{matrix}24x+27y=7,74\\x+\dfrac{3}{2}y=0,39\end{matrix}\right.\)
=> x=0,12 ; y=0,18
Để thu được kết tủa lớn nhất thì Al(OH)3 không bị tan trong NaOH
Dung dịch A : Mg2+ (0,12 mol) , Al3+ (0,18 mol)
\(Mg^{2+}+2OH^-\rightarrow Mg\left(OH\right)_2\)
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\)
=> \(n_{OH^-}=n_{NaOH}=0,12.2+0,18.3=0,78\left(mol\right)\)
=> \(V_{NaOH}=\dfrac{0,78}{2}=0,39\left(lít\right)\)

Câu 1
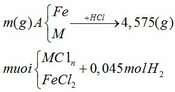
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
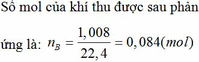
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
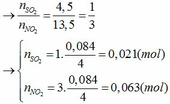
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
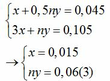
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

a) NH2SO4=0,14
NHCl=0,5
NH2=0,39
nH+=0,14.2+0,5=NH2
H+ hết
m muối =7,74+0,14.98+0,5.36,5-0,39.2=38,93
b) ddA gồm MgSO4 Al2(SO4)3
kết tủa lớn nhất khi kết tủa nhôm không bị tan trong dd kiềm và dd kiềm chỉ vừa đủ tạo thành kết tủa là Mg(OH)2 Al(OH3) BaSO4
Gọi số mol của Mg Al lần lượt là x,y ta có hệ
24x+27y=7,74 (1)
Theo pt ở đb có NH2=x+1.5y=0,39 (2)
Từ (1)(2 )có nMg=0,12 nAl=0,18
Al\(\rightarrow\)Al(OH3)
0,18\(\rightarrow\)0,18
Mg\(\rightarrow\)Mg(OH)2
0,12\(\rightarrow\) 0,12
Ba(OH)2 \(\rightarrow\)BaSO4
NH2SO4=nBaSO4=0,14
\(\rightarrow\)m kết tủa max= 0,14.233+0,18.78+0,12.58=53,62

Gọi $n_{Mg} = n_{Al} = a(mol) ; n_{Fe} = b(mol)$
Ta có :
$24a + 27a + 56b = 15,8(1)$
$n_{HCl} > 2n_{H_2}$ nên HCl dư
Ta có :
$n_{H_2} = a + 1,5a + b = \dfrac{13,44}{22,4} = 0,6(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,1
$\%m_{Al} = \dfrac{0,2.27}{15,8}.100\% = 34,18\%$
$\%m_{Mg} = \dfrac{0,2.24}{15,8}.100\% = 30,38\%$
$\%m_{Fe} = 35,44\%$
$n_{HCl\ pư} = 2n_{H_2} = 1,2(mol)$
Bảo toàn khối lượng : $m_{muối} = 15,8 + 1,2.36,5 - 0,6.2 = 58,4(gam)$

a)
nHCl=0,5.1=0,5(mol)
nH2SO4=0,5.3,8=1,9(mol)
nH2=\(\frac{8,736}{22,4}\)=0,39(mol)
Bảo toàn H ta có
0,39.2<0,5+1,9.2\(\rightarrow\) Axit dư kim loại tan hết
b)
Theo ĐLBTKL ta có
mkl+maxit=m muối+mH2
\(\rightarrow\)m muối=7,74+1,9.98+0,5.36,5-0,39.2=211,41 g
Bạn xem lại CM của H2SO4 nha
a) nH2SO4 = 1.9 mol
nHCl = 0.5 mol
nH2 = 8.736/22.4 = 0.39 mol
nH2 < nH2SO4 + 1/2nHCl =>Axit còn , hỗn hợp kim loại tan hết
Mg + 2HCl => MgCl2 + H2
Mg + H2SO4 => MgSO4 + H2
2Al + 6HCl => 2AlCl3 + 3H2
2Al + 3H2SO4 => Al2(SO4)3 + 3H2
+) Nếu : HCl còn => nHCl phản ứng = 2nH2 - 2nH2SO4 = 2*0.39 - 1.9 * 2 = -3.02 (mol)
=> Bạn xem lại đề nha

a) Mg + 2HCl → MgCl2 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
2Al + 6HCl → 2AlCl3 + 3H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
nHCl = 0,5 . 1 = 0,5 mol
nH2SO4 = 0,28 . 0,5 = 0,14 mol
nH2 =\(\frac{8,736}{22,4}\) = 0,39 mol
Nhận thấy nHCl + 2nH2SO4 = 2nH2
→ Hỗn hợp axit phản ứng vừa đủ
Bảo toàn nguyên tố Cl: nCl = nHCl = 0,5 mol
Bảo toàn gốc SO4: nSO4 = nH2SO4 = 0,14 mol
m muối = mKL + mCl + mSO4
= 7,74 + 0,5 . 35,5 + 0,14 . 96
= 38,93 (g)
b)
nKOH = V . 1 = V (mol)
nBa(OH)2 = 0,5V (mol)
Để lượng kết tủa là lớn nhất thì nKOH + 2.nBa(OH)2 = nHCl + 2.nH2SO4
→ V + 2 . 0,5V = 0,5 + 2 . 0,14



8,736l H2 có ở đktc k bạn?