Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì Y tác dụng với NaOH sinh ra khí H 2 nên có Al còn dư → Fe2O3 phản ứng hết.
Vậy Y gồm có Al dư, Al2O3 và Fe.
- Y tác dụng với NaOH sinh khí H 2 .
2Al + 2NaOH + 2H2O
→ 2NaAlO2 + 3 H 2 (1)
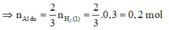
- Y tác dụng với HCl sinh khí H 2 .
2Al + 6HCl → 2 A l C l 3 +3 H 2 (2)
Fe + 2HCl → F e C l 2 + H 2 (3)
⇒ n H 2 (2) = 3/2 n A l d u = 3/2 . 0,2 = 0,3 mol
⇒ n H 2 (3) = n F e = n H 2 - n H 2 (2)
= 0,4-0,3= 0,1 mol
- Phản ứng nhiệt nhôm:
2Al + F e 2 O 3 → A l 2 O 3 + 2Fe (4)
Theo phản ứng (4) ta có:
⇒ n A l b đ = n A l d u + n A l p ư
= 0,2+0,1 = 0,3 mol⇒ Chọn A.

\(m_{Mg}=1,2\left(g\right)\)
=> \(n_{Mg}=\dfrac{1,2}{24}=0,05\left(mol\right)\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
____0,05--------------------->0,05
2Al + 6HCl --> 2AlCl3 + 3H2
\(\dfrac{1}{30}\)<--------------------0,05
=> \(m_{Al}=\dfrac{1}{30}.27=0,9\left(g\right)\)
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,9}{0,9+1,2}.100\%=42,857\%\\\%Mg=\dfrac{1,2}{0,9+1,2}.100\%=57,143\%\end{matrix}\right.\)

\(n_{Cu}=a\left(mol\right),n_{Fe}=b\left(mol\right),n_{Al}=c\left(mol\right)\)
\(m_X=64a+56b+27b=35.7\left(g\right)\left(1\right)\)
\(n_{Cl_2}=\dfrac{21.84}{22.4}=0.975\left(mol\right)\)
\(Cu+Cl_2\underrightarrow{^{^{t^0}}}CuCl_2\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}FeCl_3\)
\(Al+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}AlCl_3\)
\(n_{Cl_2}=a+1.5b+1.5c=0.975\left(mol\right)\left(2\right)\)
\(n_{hh}=ka+kb+kc=0.25\left(mol\right)\)
\(n_{H_2}=kb+k\cdot1.5c=0.2\left(mol\right)\)
\(\Leftrightarrow a-0.25b-0.875c=0\left(3\right)\)
\(\left(1\right),\left(2\right),\left(3\right):a=0.3,b=0.15,c=0.3\)
\(\%Cu=\dfrac{0.3\cdot64}{35.7}\cdot100\%=53.78\%\)
\(\%Fe=\dfrac{0.15\cdot56}{35.7}\cdot100\%=23.52\%\)
\(\text{%Al=22.7%}\)

- Phần 1: \(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\)
PTHH:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
a--------------------------->1,5a
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b--------------------------->b
\(\Rightarrow1,5a+b=0,06\left(1\right)\)
- Phần 2: Đặt hệ số tỉ lệ \(\dfrac{P_2}{P_1}=k\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=ak\left(mol\right)\\n_{Fe}=bk\left(mol\right)\end{matrix}\right.\Rightarrow ak+bk=0,15\left(2\right)\)
\(n_{H_2}=\dfrac{2,016}{22,4}=0,09\left(mol\right)\)
PTHH: \(2Al+2KOH+2H_2O\rightarrow2KAlO_2+3H_2\)
0,06<----------------------------------------0,09
\(\Rightarrow ak=0,06\left(3\right)\)
Từ \(\left(1\right),\left(2\right),\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,02\\b=0,03\\k=3\end{matrix}\right.\)
\(\Rightarrow m=\left(0,02.27+0,03.56\right)\left(3+1\right)=8,88\left(g\right)\)


$2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2$
$n_{Al} = \dfrac{2}{3}n_{H_2} = \dfrac{2}{3}.0,15 = 0,1(mol)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
$n_{H_2} = \dfrac{3}{2}n_{Al} + n_{Mg} = 0,35(mol)$
$\Rightarrow n_{Mg} = 0,35 - 0,15 = 0,2(mol)$
Vậy số mol Mg và Al là 0,2 và 0,1