Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

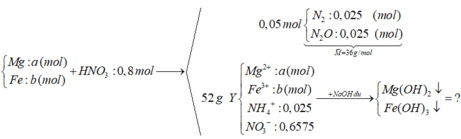
Áp dụng quy tắc đường chéo => tính được tỉ lệ nN2 : nN2O = 1: 1
=> nN2 = nN2O = 0,025 (mol)
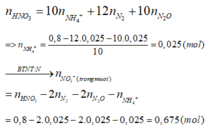
Áp dụng bảo toàn điện tích và bảo toàn khối lượng đối với các chất trong dung dịch Y ta có:
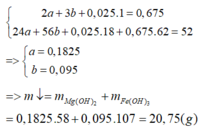
Gần nhất với 20,8 gam
Đáp án D

Đáp án A
Sơ đồ:
8 , 66 g a m M g F e 3 O 4 F e ( N O 3 ) 2 → 0 , 52 m o l H C l + 0 , 04 m o l H N O 3 1 , 12 l i t N O v à H 2 d u n g d ị c h Y → + A g N O 3 m g a m ↓ d u n g d ị c h T → N a O H ↓ → t 0 10 , 4 g a m
Ta giải được:
![]()
Do có sinh ra khí H2 nên dung dịch Y coi như đã hết N O - 3 .
Gọi a, b, c lần lượt là số mol 3 chất trong X
=> 24a + 232b + 180c = 8,66
T tác dụng với NaOH lọc kết tủa rồi nung thu được 10,4 gam rắn gồm MgO và Fe2O3.
=> 40a + 240b + 80c = 10,4
Bảo toàn N :
n N H + 4 = 2c + 0,04 - 0,035 = 2c + 0,005 mol
Bảo toàn H : n H 2 O = 0 , 255 - 4 c
Bảo toàn O 4b + 6c + 0,04.3 = 0,035 + 0,255 - 4c
Giải hệ :a=0,2 ;b=0,005; c=0,015.
Kết tủa khi cho AgNO3 vào gồm AgCl 0,52 mol và Ag
Bảo toàn e:
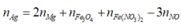
![]()
=> m = 75,16 gam

Chọn D.
Gọi a, b và c lần lượt là số mol của Mg, Fe3O4 và Fe(NO3)2.
Cho 8,66 gam X tác dụng với dung dịch hỗn hợp HCl và HNO3 thì :
+ Hỗn hợp khí Y gồm NO (0,035 mol) và H2 (0,015 mol).
+ Xét dung dịch Y ta có:

Cho Y tác dụng với NaOH, lọc kết tủa đun nóng thu được 10,4 gam hỗn hợp rắn gồm MgO (a mol) và Fe2O3 (1,5b + 0,5c) mol. Từ dữ kiện đề bài ta có hệ sau:
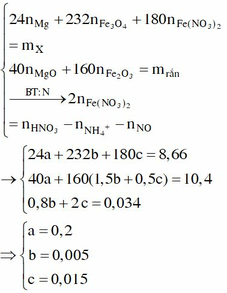
Þ n=0,035 mol Khi cho dung dịch Y tác dụng với lượng dư dung dịch với AgNO3 thì:
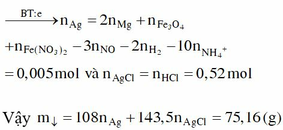

Đáp án D
Gọi số mol của Zn, ZnO, ZnCO3 lần lượt là 3x, x, x (mol)
=> 3x. 65 + 81x + 125x = 24, 06
=> x = 0,06 (mol)
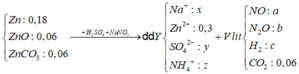
Dd Y + BaCl2 → BaSO4 : 0,34 (mol) => nSO42- =0,34 (mol) = y
Dd Y + NaOH → nOH- max = nOH- + 4 nZn2+ = 1,21 (mol)
=> nNH4+ = 1,21 – 4. 0,3 = 0,01 (mol) = z
Bảo tòan điện tích cho dd Y: ∑ n. điện tích (+) = ∑ n. điện tích (-)
=> nNa+ + 0,3. 2 + 0,01.1 = 0,34.2
=> nNa+ = 0,07 (mol) = x
BTNT N: a + 2b + 0,01 = 0,07 (1)
mT = 30a + 44b + 2c + 44.0,06 = ( a+b + c + 0,06). 436/15 (2)
Hỗn hợp ban đầu quy đổi thành Zn: 0,3 mol; O: 0,12 mol và CO2: 0,06 mol
NO3 - + 4H+ + 3e → NO + 2H2O
2NO3 - + 10H+ + 8e → N2O + 5H2O
2H+ + 2e → H2
∑n H+ = 2n H2SO4 = 4nNO + 10nN2O + 2nH2 = 4a + 10b + 2c = 0,34.2 (3)
Giải hệ (1), (2), (3) được
a = 0,04
b = 0,01
c = 0,04
=> V = (0,04+ 0,01 + 0,04+ 0,06). 22,4 = 3,36 lít gần với 3 nhất

Đáp án A
Hòa tan hết 7,44 gam hỗn hợp rắn vào 0,4 mol HCl và 0,05 mol NaNO3 thu được 22,47 gam muối và 0,02 mol hỗn hợp khí gồm NO và N2.
Giải được số mol NO và N2 đều là 0,01 mol.
Do X chứa muối nên HCl phản ứng hết.
BTKL:
![]()
BTNT H:
![]()
Cho NaOH dư vào X thu được kết tủa Y, nung Y trong không khí thu được rắn chứa MgO và Fe2O3 có khối lượng 9,6 gam.
Lượng O để oxi hóa hỗn hợp ban đầu lên tối đa là:
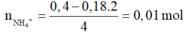
Cho AgNO3 dư tác dụng với dung dịch X ta thu được kết tủa gồm AgCl 0,4 mol (bảo toàn C) và Ag.
Bảo toàn e:
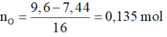
n A g = 0,135.2 - 0,01.8 - 0,013 - 0,01.10 = 0,06 mol
![]()

Đáp án C
Ta có sơ đồ phản ứng:
m(gam) (Mg, Fe) + --O2→ (m+4,16) gam B + --HCl→ D (Mg2+ x mol; Fe2+ y mol; Fe3+ z mol); Cl-)
D + --AgNO3→ (11m – 12,58) gam (Ag + AgCl)
Ta có m(O) = 4,16 gam → n(O) = 0,26 mol → n(Cl- trong D) = 0,52 mol
→ n(AgCl) = 0,52 mol
Ta có hệ phương trình
(1): 24x + 56(y+z) = m
(2) ĐLBT điện tích: 2x+2y+ 3z = 0,52
(3) m + 0,52*35,5 = 4m-6,5
→ m = 8,32 gam → n(Ag) = 0,04 = y → x = 0,16; z = 0,04
Mặt khác trong 4,5m gam A có: Mg = 0,72 mol và Fe 0,36 mol
Dung dịch muối: Mg2+: 0,72 mol; Fe3+: 0,36mol; NH4+: t mol; NO3-: q mol
hợp khí F gồm N2 (0,04 mol) và N2O (0,04 mol)
Áp dụng ĐLBT mol e: → t = 0,225 mol
Áp dụng ĐLBT điện tích → q = 2,745 mol → m 211,68 gam

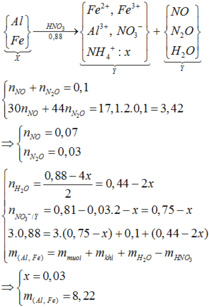
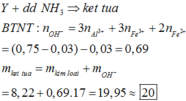

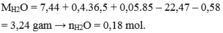


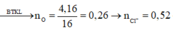
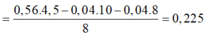

Đáp án D