Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Lập công thức hóa học của muối kẽm clorua: Z n C l 2
b) Khối lượng muối Z n C l 2 = 6,5 + 7,3 – 0,2 = 13,6 (gam)

\(m_{HCl}=50.7,3\%=3,65\left(g\right)\\ n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=n_{H_2}=n_{ZnCl_2}=\dfrac{1}{2}n_{HCl}=\dfrac{1}{2}.0,1=0,05\left(mol\right)\\ m_{Zn}=0,05.65=3,25\left(g\right)\\ V_{H_2\left(ĐKTC\right)}=0,05.22,4=1,12\left(l\right)\\ m_{ZnCl_2}=0,05.136=6,8\left(g\right)\)
mHCl=50.7,3%=3,65(g) -> nHCl=0,1(mol)
a) PTHH: Zn + 2 HCl -> ZnCl2 + H2
nH2=nZnCl2=nZn=nHCl/2= 0,1/2=0,05(mol)
b) m=mZn=0,05.65=3,25(g)
c) V(H2,đktc)=0,05.22,4=1,12(l)
d) mZnCl2= 136.0,05= 7,8(g)

Câu 1:
a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{Zn}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,25\left(mol\right)\Rightarrow V_{H_2}=0,25.22,4=5,6\left(l\right)\)
c, \(n_{HCl}=2n_{Zn}=0,5\left(mol\right)\Rightarrow m_{Zn}=0,5.36,5=18,25\left(g\right)\)
Câu 2:
a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, \(n_P=\dfrac{1,24}{31}=0,04\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{5}{4}n_P=0,05\left(mol\right)\Rightarrow V_{O_2}=0,05.22,4=1,12\left(l\right)\)
c, \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,02\left(mol\right)\Rightarrow m_{P_2O_5}=0,02.142=2,84\left(g\right)\)

Zn+2HCl->ZnCl2+H2
0,2-----0,4---0,2----0,2
nZn=0,2 mol
=>m Hcl=0,4.36,5=14,6g
m muối=0,2.136=27,2g
=>VH2=0,2.22,4=4,48l
`Zn + 2HCl -> ZnCl_2 + H_2` `\uparrow`
`n_(Zn) = 13/65 = 0,2 mol`.
`n_(HCl) = 0,4 mol`.
`m_(HCl) = 0,4 xx 36,5 = 14,6g`.
c, `m_(ZnCl_2) = 0,2 xx 127 = 25,4 g`.
`d, V_(H_2) = 0,2 xx 22,4 = 4,48l`.

nZn = m/M = 26/65 = 0,4 (mol)
pthh: Zn + 2HCl -> ZnCl2 + H2
........1mol...2mol........1 mol.......1 mol
.......0,4mol..x mol........y mol........z mol
a, Từ ptpu ta có: \(n_{H_2}=z=\dfrac{0,4.1}{1}=0,4\left(mol\right)\)
=>\(V_{H_2}=n.22,4=0,4.22,4=8,96\left(l\right)\)
b, Từ ptpu ta có: \(n_{ZnCl_2}=y=\dfrac{0,4.1}{1}=0,4\left(mol\right)\)
=>\(m_{ZnCl_2}=n.M=0,4.\left(65+35,5.2\right)=0,4.136=54,4\left(g\right)\)
c, \(m_{H_2}=n.M=0,4.2=0,8\left(g\right)\)
Từ ptpu ta có: \(n_{HCl}=x=\dfrac{0,4.2}{1}=0,8\left(mol\right)\)
=>\(m_{HCl}=n.M=0,8.\left(1+35,5\right)=29,2\left(g\right)\)
Lại có: mchất tham gia = mZn + mHCl = 26+29,2 =55,2(g)
msản phẩm = mH2 + mZnCl2 = 0,8 + 54,4 = 55,2 (g)
=>\(\dfrac{m_{chatthamgia}}{m_{sanpham}}=\dfrac{55,2}{55,2}=1\)

\(a,PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(b,n_{Zn}=\dfrac{m}{M}=\dfrac{16,25}{65}=0,25\left(mol\right)\\ Theo.PTHH:n_{HCl}=2.n_{Zn}=2.0,25=0,5\left(mol\right)\\ m_{HCl}=n.M=0,5.36,5=18,25\left(g\right)\)
\(Theo.PTHH:n_{H_2}=n_{Zn}=0,25\left(mol\right)\\ V_{H_2\left(đktc\right)}=n.22,4=0,25.22,4=5,6\left(l\right)\)
a)PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b)Khối lượng Zn:\(m_{Zn}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
Ta có: \(n_{HCl}=2n_{Zn}=0,5\left(mol\right)\)
Khối lượng axit HCl cần dùng là: \(m_{HCl}=0,5.36,5=18,25\left(g\right)\)
c)Theo pt ta có: \(n_{H_2}=n_{Zn}=0,25\left(mol\right)\)
Thể tích H2 là: \(V_{H_2}=n.22,4=0,25.22,4=5,6\left(ml\right)\)

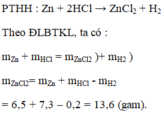

a) Zn + 2HCl --> ZnCl2 + H2
b) \(n_{H_2}=\dfrac{6,1975}{24,79}=0,25\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,25<-0,5<---0,25<--0,25
=> mZn = 0,25.65 = 16,25 (g)
c) mZnCl2 = 0,25.136 = 34 (g)
C ?