Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hoà tan K vào nước thu được 2,24 lít khí H2 (đktc). Tính : a) khối lượng bazơ sinh ra b) Dùng lượng H2 trên khử 14,4 ga... - Hoc24
Khi nãy bạn đã đăng một câu y hệt, mình trả lời rồi nhé!

nAl = 5,4/27 = 0,2 (mol)
PTHH: 2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
nH2 = 0,2 : 2 . 3 = 0,3 (mol)
VH2 = 0,3 . 22,4 = 6,72 (l)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
nFe = 0,3 : 3 . 2 = 0,2 (mol)
a = mFe = 0,2 . 56 = 11,2 (g)
nFe2O3 = 0,3/3 = 0,1 (mol)
mFe2O3 = 0,1 . 160 = 16 (g)
m = 16/60% = 80/3 (g)

\(n_K=\dfrac{7,8}{39}=0,2\left(mol\right)\\ a,2K+2H_2O\rightarrow2KOH+H_2\uparrow\\ n_{H_2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ V_{H_2\left(\text{đ}ktc\right)}=0,1.22,4=2,24\left(l\right)\\ b,n_{KOH}=n_K=0,2\left(mol\right)\\ m_{KOH}=0,2.56=11,2\left(g\right)\\ c,m_{\text{dd}sau}=m_K+m_{H_2O}-m_{H_2}\)
Nhưng chưa có KL nước?

Giả sử khối lượng hỗn hợp a là 100g
Gọi số mol Fe, FeO và Fe2O3 lần lượt là x, y, z
->56x+72y+160z=100 (1)
Vì khối lượng H2 thoát ra bằng 1,00% khối lượng hỗn hợp đem thí nghiệm mH2=1%.100=1g
=> nH2=\(\dfrac{1}{2}\)=0,5mol
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT nFe = nH2 = 0,5mol =x (2)
Vì khử a gam hỗn hợp trên bằng H2 dư thì thu được khối lượng nước bằng 21,15% lượng hỗn hợp đem thí nghiệm.
=> mH2O=21,15%.100 = 21,15g
->nH2O=\(\dfrac{21,15}{18}\)=1,175mol
PTHH: \(FeO+H_2\rightarrow Fe+H_2O\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
Ta có: \(n_{H_2O}=\) y+3z=1,175 (3)
Từ (1), (2), (3) =>x=0,5; y=0,5; z=0,225
->%mFe=\(\dfrac{0,5.56}{100}=28\%\)
->%mFeO=\(\dfrac{0,5.72}{100}=36\%\)
->%mFe2O3=100-28-36 = 36%

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,3 0,6 0,3 ( mol )
\(m_{Fe\left(pứ\right)}=0,3.56=16,8g\)
\(m_{Fe\left(dư\right)}=28-16,8=11,2g\)
\(m_{HCl}=0,6.36,5=21,9g\)

\(m_{H_2}=0,01a\left(g\right)\)
=> \(n_{H_2}=\dfrac{0,01a}{2}=0,005a\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,005a<----------------0,005a
=> mFe = 56.0,005a = 0,28a (g)
Gọi số mol FeO, Fe2O3 là x, y (mol)
=> 72x + 160y = a - 0,28a = 0,72a (1)
\(m_{H_2O}=0,2115a\left(g\right)\)
=> \(n_{H_2O}=\dfrac{0,2115a}{18}=0,01175a\left(mol\right)\)
PTHH: FeO + H2 --to--> Fe + H2O
x---------------------->x
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
y----------------------------->3y
=> x + 3y = 0,01175a (2)
(1)(2) => \(\left\{{}\begin{matrix}x=0,005a\left(mol\right)\\y=0,00225a\left(mol\right)\end{matrix}\right.\)
=> \(\%Fe=\dfrac{0,28a}{a}.100\%=28\%\)
\(\%FeO=\dfrac{72.0,005a}{a}.100\%=36\%\)
\(\%Fe_2O_3=\dfrac{160.0,00225a}{a}.100\%=36\%\)
\(m_{H_2}=0,01a\left(g\right)\\ \Rightarrow n_{Fe}=n_{H_2}=0,005a\left(mol\right)\\\Rightarrow m_{FeO,Fe_2O_3}=a-0,005a.56=0,72a\\ Đặt:n_{FeO}=x\left(mol\right);n_{Fe_2O_3}=y\left(mol\right)\left(x,y>0\right)\\ \Rightarrow72x+160y=0,72a\left(1\right)\\ m_{H_2O}=0,2115a\\ \Leftrightarrow18x+54y=0,2115a\left(2\right)\\ \left(1\right),\left(2\right)\Rightarrow\dfrac{504}{47}x=\dfrac{1120}{47}y\\ \Rightarrow\dfrac{x}{y}=\dfrac{\dfrac{1120}{47}}{\dfrac{504}{47}}=\dfrac{20}{9}\\ \Rightarrow\%m_{Fe}=\dfrac{0,28a}{a}.100=28\%\\Ta.có:x.72+0,45x.160=0,72a\\ \Leftrightarrow144x=0,72a\\ \Leftrightarrow\dfrac{x}{a}=\dfrac{0,72}{144}=0,005\\ \Rightarrow\%m_{FeO}=\dfrac{72.0,005a}{a}.100=36\%\)
\(\Rightarrow\%m_{Fe_2O_3}=100\%-\left(28\%+36\%\right)=36\%\)

`FeO + H_2` $\xrightarrow[]{t^o}$ `Fe + H_2 O`
`a) n_[H_2] = [ 3,36 ] / [ 22,4 ] = 0,15 (mol)`
`n_[FeO] = [ 14,2 ] / 72 = 71 / 360`
Ta có: `[ 0,15 ] / 1 < [ 71 / 360 ] / 1`
`=> FeO` dư
Theo `PTHH` có: `n_[FeO_\text{(p/ứ)}] = n_[H_2] = 0,15 (mol)`
`=> n_[FeO_\text{(dư)}] = 71 / 360 - 0,15 = 17 / 360 (mol)`
_______________________________________________
`b)` Theo `PTHH` có: `n_[Fe] = n_[H_2] = 0,15 (mol)`
`=> m_[Fe] = 0,15 . 56 = 8,4 (g)`

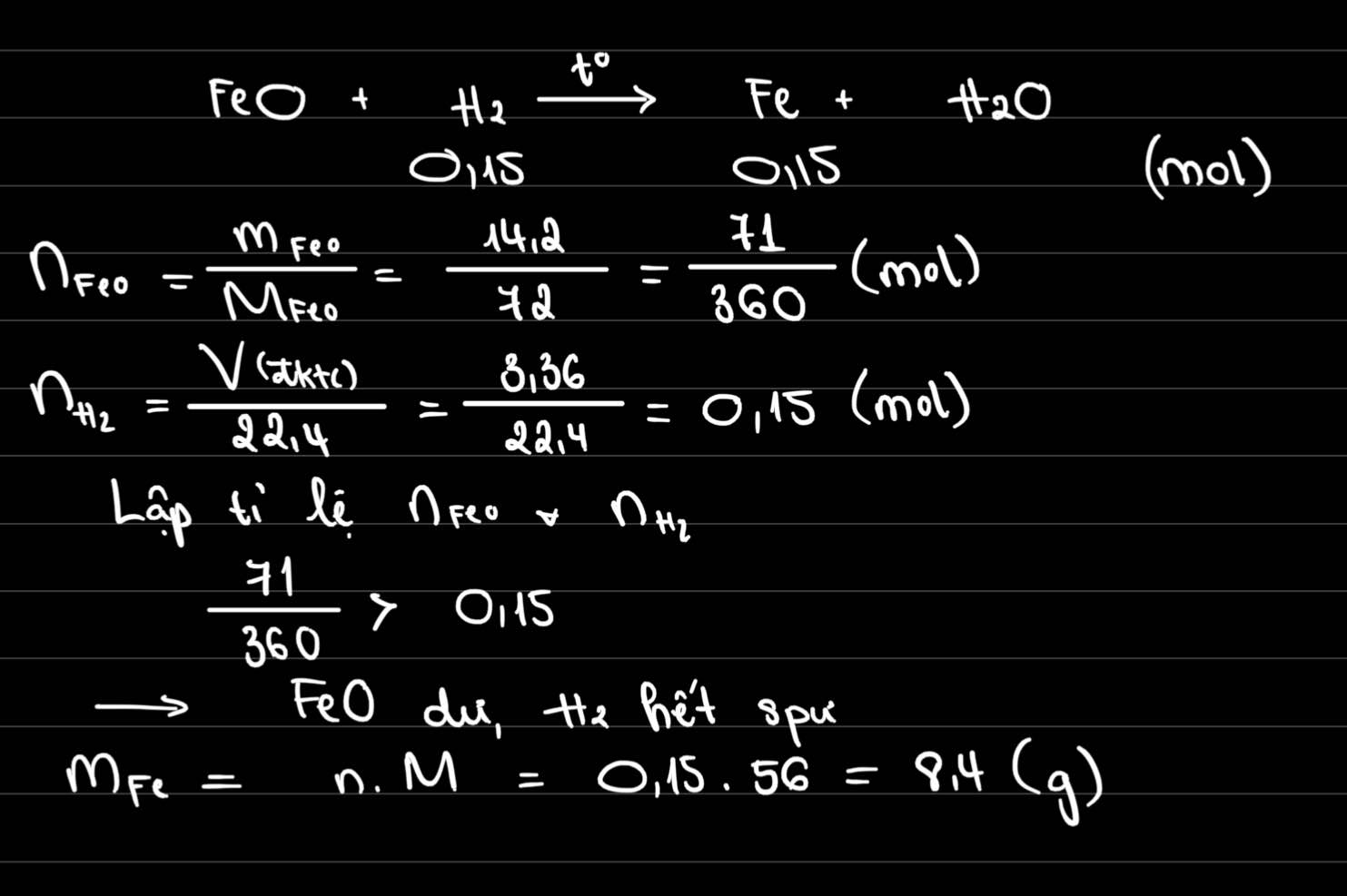

a, Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PT: \(2K+2H_2O\rightarrow2KOH+H_2\)
__________________0,2____0,1 (mol)
⇒ mKOH = 0,2.56 = 11,2 (g)
b, PT: \(FeO+H_2\underrightarrow{t^o}Fe+H_2O\)
Ta có: \(n_{FeO}=\dfrac{14,4}{72}=0,2\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,1}{1}\), ta được FeO dư.
Theo PT: \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
Bạn tham khảo nhé!