Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Ta có: nHCl= 0,45 mol; n C O 2 = 5,6/22,4= 0,25 mol.
Giả sử ban đầu có x mol NaHCO3
CO32- + H+ → HCO3- (1)
HCO3-+ H+ → CO2+ H2O (2)
0,25 0,25 ←0,25
Theo PT (2): n H C O 3 - = n H + = n C O 2 = 0,25 mol
→ n H + PT1 = 0,45- 0,25 = 0,2 mol
→ n C O 3 2 - PT1 = n H + = n H C O 3 - PT1 = 0,2 mol
→ n N a 2 C O 3 = n C O 3 2 - PT1= 0,2 mol
→ C M N a 2 C O 3 = 0,2/ 0,5 = 0,4M
Dung dịch Y chứa Na+, HCO3- dư: x+0,2- 0,25= x- 0,05 mol
HCO3-+ OH- → CO32-+ H2O
Ba2++ CO32- → BaCO3
Ta thấy: n H C O 3 - = n C O 3 2 - = n B a C O 3 = 19,7/197 = 0,1 mol
→ x- 0,05 = 0,1 → x = 0,15 mol
→ C M N a H C O 3 = 0,15/ 0,5 = 0,3M

Tóm tắt: 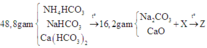
Gọi a; b; c lần lượt là số mol của NH4HCO3, NaHCO3 và Ca(HCO3)2
Ta có: 89a + 84b + 162c =48,8 (l)
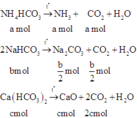
Khối lượng của hỗn hợp rắn là: 53b + 56c = 16,2 (2)
Hỗn hợp khí X gồm NH3 (a mol) và CO2 (a + b 2 + 2c)
⇒ n x = (2a + b 2 + 2c)
Khi X ở nhiệt độ 180 – 200°C, dưới áp suất khoảng 200 atm thì đây chính là phản ứng điều chế đạm urê nên ta có phản ứng:
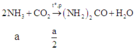
NH3 phản ứng với CO2 theo tỉ lệ 1:2 lượng khí Z còn lại chính là CO2 ⇒ n z = a 2 + b 2 . 2 c
Do sau phản ứng đưa về nhiệt độ ban đầu nên ta có:
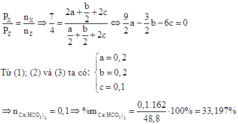
Đáp án A.

- Đáp án A
- Gọi số mol của Na2CO3 là x và của K2CO3 là y mol
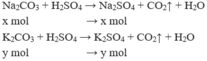
Ta có hệ phương trình:
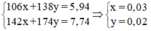
⇒ mNa2CO3= 106.0,03 = 3,18 (gam)
mK2CO3= 138.0,02 = 2,76 (gam)
⇒ Đáp án A

Gọi $n_{K_2CO_3} = a(mol) ; n_{Na_2CO_3} = b(mol) \Rightarrow 138a + 106b = 5,94(1)$
\(K_2CO_3+H_2SO_4\rightarrow K_2SO_4+CO_2+H_2O\)
a...................................a....................................(mol)
\(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2+H_2O\)
b.......................................b..................................(mol)
Suy ra: $174a + 142b = 7,74(2)$
Từ (1)(2) suy ra a = 0,02 ; b = 0,03
$m_{K_2CO_3} = 0,02.138 = 2,76(gam)$
$m_{Na_2CO_3} = 0,03.106 = 3,18(gam)$
Đáp án A

Đáp án A
Đặt n K2CO3 = n NaHCO3 = a mol
n Ba(HCO3)2 = b
=> n HCO3 = 2 b + a
=> n CO3 = a
n NaOH = 0.2 mol => n HCO3 = 0,2 mol
n HCl = n H+ = 2 n CO3 + n HCO3 = 0,28 mol
=> n CO3 = ( 0,28 – 0,2 ) : 2 = 0.04 mol
=>a = 0.04 và 2 b + a = 0,2 mol
=> b = 0,08
b > a => n Ba> n CO3 => tính theo CO32‑
m BaCO3 = 0,04 . 197 = 7,88 g

Đáp án B
Đặt n K 2 C O 3 = n N a H C O 3 = a mol; n B a ( H C O 3 ) 2 = b mol
Ta có phản ứng:
Ba2++ CO32-→BaCO3↓(∗)
b a mol
Khi cho HCl vào bình đến hết thoát khí, HCl sẽ phản ứng với BaCO3, NaHCO3, Ba(HCO3)2, K2CO3 có trong bình.
Ta có:
2H+ + CO32- → H2O + CO2
H+ + HCO3- → H2O + CO2
Ta có: ∑
n
C
O
3
2
-
= a mol
∑
n
H
C
O
3
-
= a+2b mol
nHCl = nH+ = 0,56 × 0,5 = 0,28 mol
⇒ 2a + a + 2b = 0,28 (1)
Khi cho dung dịch Y tác dụng vừa đủ dung dịch NaOH, chỉ có HCO3- phản ứng.
HCO3- + OH- → H2O + CO32-
⇒
n
H
C
O
3
-
=
n
O
H
-
⇔ a + 2b = 0,2 (2)
Từ (1), (2) ⇒ a = 0,04; b = 0,08
Thế a, b vào phương trình (*)
⇒
m
B
a
C
O
3
=197×a =197×0,04 =7,88 g

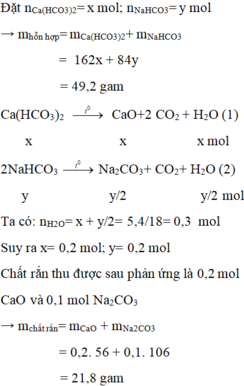
Các phản ứng phân hủy muối khi nung :
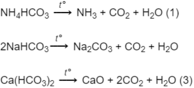
Bã rắn thu được sau khi nung gồm N a 2 C O 3 và CaO, chúng tan trong dung dịch HCl dư theo các phương trình hoá học :
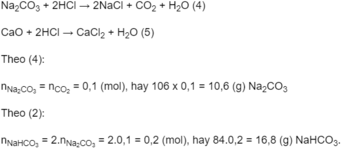
Số mol CaO có trong bã rắn: 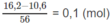
Theo (3):
![]()
Khối lượng N H 4 H C O 3 có trong hỗn hợp: 48,8 - (16,8 + 16,2) = 15,8 (g).
Thành phần phần trăm của hỗn hợp muối:
%
m
N
H
4
H
C
O
3
= 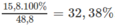
%
m
N
a
H
C
O
3
= 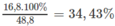
%
m
C
a
(
H
C
O
3
)
2
= 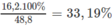


Chọn đáp án C