Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Cho hỗn hợp chất rắn phản ứng với HCl dư có Cu không phản ứng.
Phương trình hóa học:
F e + 2 H C l → F e C l 2 + H 2 F e O + 2 H C l → F e C l 2 + H 2 O


Chọn C
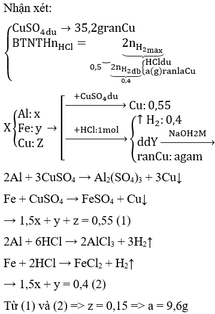
Gọi số mol của Fe và Al lần lượt là x và y mol

Muối trong dung dịch A gồm x mol F e S O 4 và 0,5y mol A l 2 ( S O 4 ) 3


Chỉ có Al td vs HCl →H2 suy ra mol Al=0,1mol
sau đó Al bị thụ động trong HNO3đặc,nguội nên chỉ có Cu td vs Hno3 →NO2 bảo toàn e suy ra mol Cu=0,15mol.
mg=mal+mcu=12,3g

a) Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\left(\text{Đ}K:a,b>0\right)\)
PTHH: Zn + H2SO4 ---> ZnSO4 + H2
a------>a---------->a----------->a
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
b----->1,5b--------->0,5b------->1,5a
=> \(\left\{{}\begin{matrix}65a+27b=20,3\\161b+0,5a.342=65,9\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,25\\b=0,15\end{matrix}\right.\)
=> \(V=V_{H_2}=\left(0,25+0,15.1,5\right).22,4=10,64\left(l\right)\)
b) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,25.65}{20,3}.100\%=80,05\%\\\%m_{Al}=100\%-80,05\%=19,95\%\end{matrix}\right.\)
c) \(m_{\text{dd}H_2SO_4}=\dfrac{\left(0,25+1,5.0,15\right).98}{10\%}=465,5\left(g\right)\)

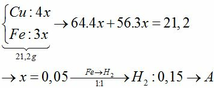

$n_{Al} = \dfrac{8,1}{27} = 0,3(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$FeO + H_2SO_4 \to FeSO_4 + H_2O$
$n_{H_2} = \dfrac{3}{2}n_{Al} = 0,45(mol)$
$V = 0,45.22,4 = 10,08(lít)$
\(n_{Al}=\frac{8,1}{27}=0,3mol\\ 2Al+3H_2SO_4\rightarrow Al_2(SO_4)_3 +3H_2 n_{H_2}=0,45mol\\ V=10,08l\)