Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Để so sánh được tính acid và base của các oxide và hydroxide dựa vào vị trí nguyên tố tạo nên chúng trong bảng tuần hoàn nguyên tố hóa học cần ghi nhớ:
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.

Ví dụ: Nguyên tố X thuộc chu kì 3, nhóm VIIA.
⇒ Nguyên tử X có 3 lớp electron và 7 electron lớp ngoài cùng.
⇒ Cấu hình electron của X là 1s2 2s2 2p6 3s2 3p5.
- Do có 7 electron lớp ngoài cùng nên nguyên tố X là phi kim.
- Công thức oxide ứng với hóa trị cao nhất là X2O7 là acidic oxide.
- Công thức hydroxide ứng với hóa trị cao nhất là HXO4 là acid mạnh.

- Sr (Z = 38): 1s22s22p63s23p64s23d104p65s2
Cấu hình e rút gọn: [Kr] 5s2
- Sr ở ô số 38, chu kì 5, thuộc nhóm IIA.
- Hydroxit của Sr là: Sr(OH)2, là một base mạnh.

Đáp án A.
Gọi M là nguyên tử khối trung bình của 2 kim loại A và B
Khi đó công thức oxit chung là ![]()
Ta có phản ứng
![]()
0,03 0,18
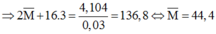
Suy ra phải có 1 kim loại có nguyên tử khối bé hơn 44,4 và 1 kim loại có nguyên tử khối lớn hơn 44,4
+ Nếu kim loại thuộc nhóm IIIA có nguyên tử khối nhỏ hơn 44,4 và thuộc chu kì 3 hoặc 4 thì chỉ có thể là Al (A = 27; Z = 13)
Kim loại còn lại có số hiệu nguyên tử bằng (A = 56)
Tổng số khối khi đó là 27 + 56 = 83
+ Nếu kim loại thuộc nhóm IIIA có nguyên tử khối lớn hơn 44,4 và thuộc chu kì 3 hoặc 4 thì chỉ có thể là Ga (A = 70; Z = 31)
Kim loại còn lại có số hiệu nguyên tử:


Nguyên tố atatin (Z = 85) thuộc chu kì 6, nhóm VIIA nên có 85e phân bố thành 6 lớp, lớp ngoài cùng có 7e nên thể hiện tính phi kim. At ở cuối nhóm VIIA, nên tính phi kim yếu nhất trong nhóm.

a) Fr là kim loại mạnh nhất. F là phi kim mạnh nhất.
b) Các kim loại được phâ bố ở khu vực bên trái trong bảng tuần hoàn.
c) Các phi kim được phân bố ở khu vực bên phải trong bảng tuần hoàn.
d) Nhóm IA gồm những kim loại mạnh nhất. Nhóm VIIA gồm những phi kim mạnh nhất.
e) Các khí hiếm nằm ở nhóm VIIIA ở khu vực bên phải trong bảng tuần hoàn.

Nguyên tố atatin (Z = 85) thuộc chu kì 6, nhóm VIIA nên có 85e phân bố thành 6 lớp, lớp ngoài cùng có 7e nên thể hiện tính phi kim. At ở cuối nhóm VIIA, nên tính phi kim yếu nhất trong nhóm.


- Vì hydroxide của T có tính base rất mạnh, tác dụng với HCl nên T là kim loại ⟹ T có thể thuộc nhóm IA hoặc IIA.
- Tỉ lệ mol giữa hydroxide của T và HCl là 1 : 2 ⟹ CTHH của muối tạo thành là TCl2 ⟹ T có hóa trị II.
⟹ T thuộc nhóm IIA, nhóm kim loại kiềm thổ nên hydroxide có tính base rất mạnh.