Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Vì hai bình điện phân mắc nối tiếp nên số mol electron trao đổi ở hai bình điện phân là như nhau.
Ở hai bình đều không thấy khí ở catot thoát ra nên ở catot của hai bình chưa có sự điện phân nước.
Áp dụng định luật bảo toàn mol electron, ta có:
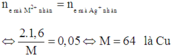

Đáp án B
Do hai bình mắc nối tiếp điện tích qua chúng không đổi, dẫn tới số mol e trao đổi của chúng bằng nhau:
![]()

Đáp án A
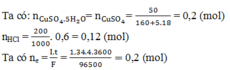
Thứ tự điện phân tại catot và anot là:
Tại catot: Cu2+ + 2e → Cu
0,1 0,2 0,1
⟹ Cu2+ chưa bị điện phân hết.
⟹ mkim loại ở catot = 0,1.64 = 6,4 (gam)
Tại anot: 2Cl– → Cl2 + 2e
0,12 0,06 0,12
⟹ ne (do Cl– nhường) = 0,12 < 0,2 mol
⟹ tại anot Cl– đã bị điện phân hết và đến nước bị điện phân.
Ta có: ne (do H2O nhường) = 0,2 – 0,12 = 0,08 (mol)
2H2O → O2 + 4H + 4e
0,02 ⟵ 0,08
Vkhí thoát ra ở anot = (0,06 + 0,02).22,4 = 1,792 (lít).

Đáp án A
Thứ tự các phản ứng điện phân xảy ra:
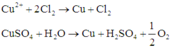
Do đó kim loại bám vào catot là Cu, khí thoát ra ở anot là Cl2, có thể có O2.
![]()
Áp dụng định luật bảo toàn mol electron, ta có:
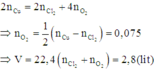


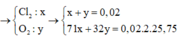
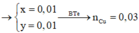
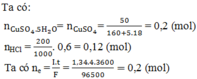


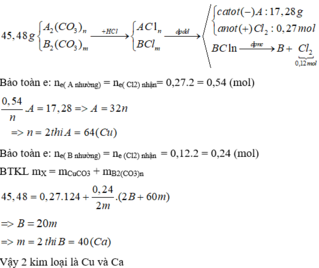

Đáp án A
- 2 bình mắc nối tiếp nên dòng điện chạy qua có cùng cường độ
Đổi 3 phút 13 giây = 193 giây; 9 phút 39 giây = 579 giây
- Phương trình điện phân
Bình 1:
Bình 2:
+ Bình 2:
=> Chứng tỏ Ag+ còn dư sau khi điện phân 193s, có thể còn dư sau điện phân 579s
Điện phân 193s :
+ Bình 1:
=> Chứng tỏ M2+ ở bình 1 bị điện phân trước, sau khi điện phân 193s thì M2+ còn dư; sau khi điện phân 579s thì M2+ hết; H+ đã bị điện phân
Điện phân 193s:
=> M là Cu => 0,8 a = 3 , 2 64 => a = 0,0625(M)